Soluzione tampone ammoniacale
La preparazione di una soluzione tampone ammoniacale costituita da ammoniaca e cloruro di ammonio costituisce un passaggio fondamentale per rendere stabile il pH di una soluzione. Una soluzione tampone ammoniacale è utilizzata, ad esempio, per stabilizzare i livelli di pH negli impianti di trattamento delle acque.

Una soluzione tampone ammoniacale è utilizzata inoltre nella calibrazione di un pHmetro, in alcune sintesi organiche che avvengono a un determinato valore di pH e soprattutto nelle titolazioni complessometriche con EDTA per la determinazione della durezza dell’acqua.
L’EDTA ovvero l’acido etilendiamminotetracetico, sintetizzato per la prima volta dal chimico austriaco Ferdinand Münz, è un acido poliammino carbossilico solubile in acqua dotato di due doppietti elettronici appartenenti all’azoto ed è pertanto soggetto a quattro equilibri di dissociazione. Il pH ottimale per la determinazione degli ioni Ca2+ e Mg2+ è pari a 10 e pertanto è utilizzata una soluzione tampone ammoniacale.
Soluzioni tampone e pH
Le soluzioni tampone sono costituite da un acido debole e dalla sua base coniugata come, ad esempio, acido acetico–acetato di sodio o da una base debole e dal suo acido coniugato come la soluzione ammoniacale.
La caratteristica delle soluzioni tampone è che il pH di tali soluzioni rimane pressoché invariato in seguito all’aggiunta di piccole quantità di acido o base forte o di un agente che tende ad alterare la concentrazione idrogenionica.
L’equazione di Henderson-Hasselbalch, dovuta al chimico statunitense Lawrence Joseph Henderson e al chimico danese Karl Albert Hasselbalch è utilizzata per conoscere pH, concentrazione di un acido o della sua base coniugata, rapporto tra le concentrazioni della base coniugata e dell’acido e pKa dell’acido debole di una soluzione tampone ovvero nel caso di una soluzione tampone costituita da una base debole e dal suo acido coniugato consente di determinare pOH, concentrazione di una base o del suo acido coniugato, rapporto tra le concentrazioni dell’acido coniugato e dalla base e pKb della base debole
L’equazione di Handerson-Hasselbalch, nel caso di una soluzione tampone costituita da un acido debole e dalla sua base coniugata è espressa come:
pH = pKa + log [A–]/[HA]
mentre, nel caso di una base debole e del suo acido coniugato come:
pOH = pKb + log [BH+]/[B]
La capacità tamponante β, ovvero la misura quantitativa di come una soluzione tampone possa mantenere praticamente invariato il suo pH, è espressa dall’equazione di Van Slyke . Il massimo potere tamponante βmax si verifica quando il rapporto tra base coniugata e acido o tra acido coniugato e base è uguale a 1 ovvero quando pH = pKa o pOH = pKb.
EDTA e soluzione ammoniacale
L’EDTA, comunemente utilizzato per le titolazioni complessometriche, è un agente chelante che può essere virtualmente utilizzato per l’analisi di tutti gli ioni metallici. È un acido di Lewis e presenta sei possibili siti di legame costituiti da quattro gruppi carbossilato e dal doppietto elettronico solitario presente su ciascuno dei due atomi di azoto.
In una tipica determinazione analitica l’EDTA, al fine di complessare uno ione metallico si deve presentare sotto forma di Y4-.
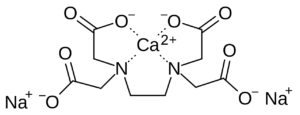
La formazione del complesso metallo-EDTA con lo ione Ca2+ può essere rappresentato dall’equilibrio:
Ca2+ + Y4- ⇄ CaY2-
per il quale la costante di equilibrio, detta costante di formazione, Kf la cui espressione è:
Kf = [CaY2-]/ [Ca2+][ Y4-]
vale 4.90 · 1010. Questo valore elevato indica che il complesso è stabile e l’equilibrio è spostato verso destra.
La forma Y4- è predominante quando il valore di pH è di circa 10 pertanto la soluzione tampone ammoniacale deve avere questo valore di pH. Per la titolazione dello ione calcio con EDTA si deve usare un indicatore metallocromico come il Nero eriocromo T.
Preparazione della soluzione tampone ammoniacale
Per la preparazione della soluzione ammoniacale è necessario conoscere la concentrazione dell’ammoniaca e dello ione ammonio. Applicando l’equazione di Henderson-Hasselbalch per ottenere una soluzione a pH = 10 il valore di pOH è pari a 4. Poiché il valore di Kb dell’ammoniaca è pari a 1.80 · 10-5 e, conseguentemente il valore di pKb = – log Kb = – log 1.80 · 10-5 = 4.74 dall’equazione di Henderson-Hasselbalch si ha:
4 = 4.74 + log [NH4+]/[NH3]
da cui 4- 4.74 = – 0.74 = log [NH4+]/[NH3]
ovvero 10-0.74 = 0.18 = [NH4+]/[NH3]
Una soluzione di ammoniaca concentrata ha una concentrazione del 28% m/m e una densità di 0.900 g/mL. Ciò implica che in 100 g di soluzione sono contenuti 28 g di ammoniaca ovvero 28 g/17.031 g/mol = 1.65 moli. Il volume pari a 100 g si ricava dalla densità: V = massa/densità = 100 g/0.900 g/mL = 111 mL
La concentrazione molare dell’ammoniaca è pari a M = 1.65 mol/ 0.111 L = 14.9
Poiché [NH4+]/[NH3] = 0.18 si può considerare [NH4+] = 0.18 M e [NH3] = 1 M
volendo preparare 100 mL di soluzione ammoniacale sono quindi necessarie 0.18 mol/L · 0.100 L = 0.018 moli di NH4Cl corrispondenti a: 0.018 mol · 53.491 g/mol = 0.963 g di cloruro di ammonio.
Per ottenere 1000 mL di NH3 a concentrazione 1 M si usa la formula delle diluizioni: M1V1 = M2V2. Sostituendo si ha: 14.9 · V = 1 · 100
Da cui V = 6.7 mL
Pertanto per la preparazione della soluzione ammoniacale si solubilizzano 0.963 g di cloruro di ammonio in acqua distillata e si aggiungono 6.7 mL di ammoniaca concentrata diluendo infine a 100 mL



