Standardizzazione di EDTA
La standardizzazione di EDTA con carbonato di calcio è uno dei metodi utilizzati per standardizzare l’EDTA, ovvero l’acido etilendiamminotetraacetico, acido tetracarbossilico sintetizzato per la prima volta dal chimico austriaco Ferdinand Münz, in cui sono presenti quattro equilibri di dissociazione:
YH4 => YH3– + H+ => YH22- + H+=> YH3- + H+=> Y4- + H+
In ambiente basico è presente sotto forma di Y4- che rappresenta l’EDTA completamente deprotonato nei suoi 4 gruppi carbossilici presenti nella molecola che forma complessi con molti ioni metallici in rapporto stechiometrico di 1:1.
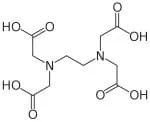
Questo è il motivo per il quale, sia nelle titolazioni complessometriche che nella standardizzazione di EDTA, si utilizza un ambiente basico (pH tra 9 e 10). L’EDTA è utilizzato nelle titolazioni complessometriche per la titolazione, in particolare, dello ione calcio e dello ione magnesio nella determinazione della durezza delle acque.
L’EDTA non è usato come standard primario infatti la forma H4Y è scarsamente solubile in acqua mentre la forma Na2H2Y2· 2 H2O deve essere messa in stufa a 80°C per eliminare l’acqua di idratazione per alcuni giorni.
I migliori risultati nella standardizzazione di EDTA si ottengono utilizzando lo stesso metodo e lo stesso catione che è successivamente determinato. Pertanto dato che l’EDTA è spesso utilizzato per la determinazione di calcio e magnesio si esegue spesso la standardizzazione di EDTA con carbonato di calcio.
Nelle titolazioni complessometriche si utilizzano indicatori metallocromici costituiti da composti organici che formano complessi stabili con alcuni ioni metallici. Gli indicatori metallocromici devono pertanto avere i seguenti requisiti:
- formare complessi con l’analita
- avere una costante di formazione minore con l’analita rispetto a quella tra analita e titolante
- avere una differente colorazione quando sono presenti nella forma libera e nella loro forma complessata
- presentare selettività
È necessario inoltre che la reazione di complessazione tra indicatore e analita deve essere rapidamente reversibile.

La standardizzazione di EDTA è effettuata in presenza di indicatori metallocromici come il nero eriocromo T. Poiché gli indicatori metallocromici sono sostanze con caratteristiche acido-base la loro dissociazione è influenzata dal pH ed è quindi necessario operare in un intervallo di pH opportuno.
Si pone il nero eriocromo T nel campione di acqua in presenza di una soluzione tampone a pH basico come la soluzione tampone costituita da ammoniaca e dallo ione ammonio che è il suo acido coniugato sotto forma di cloruro di ammonio.
La soluzione assumerà una colorazione viola ciclamino. Titolando il campione con l’EDTA, i cationi in soluzione si complessano preferenzialmente con quest’ultimo, fino a giungere al punto di equivalenza oltre il quale la soluzione passa da una colorazione viola-rossa ad una blu scuro.
Procedimento
Preparazione della soluzione di EDTA a titolo approssimato 0.01 M
Pesare circa 3.7 g di EDTA bisodico biidrato C10H14N2Na2O8 · 2 H2O (MM: 372.24 g/mol) e metterlo in un beker di 1.5 L. Aggiungere 1.0 L di acqua e riscaldare lentamente la soluzione su una piastra riscaldante agitando con un’ancoretta magnetica. Quando tutto il sale si è solubilizzato lasciar raffreddare.
Preparazione della soluzione standard di Ca2+
Pesare accuratamente circa 0.4 g di carbonato di calcio (MM = 100.0869 g/mol) che costituisce lo standard primario precedentemente essiccato a 110 °C. Trasferire il solido in un matraccio tarato da 500 mL, utilizzando circa 100 mL di acqua. Aggiungere goccia a goccia acido cloridrico 6 M fino a quando l’effervescenza cessa e la soluzione risulta limpida. Portare a volume con acqua distillata
Standardizzazione di EDTA con carbonato di calcio
Mettere un’aliquota da 50.0 mL della soluzione di carbonato di calcio con una pipetta tarata in una beuta da 250 mL e aggiungere circa 10 mL di soluzione tampone ammoniaca-cloruro di ammonio a pH = 10 e qualche goccia di indicatore. Procedere alla titolazione

Supponendo di aver pesato 0.412 g di carbonato di calcio le moli sono pari a:
Moli di CaCO3 = 0.412 g/100.0869 g/mol= 0.00412
Concentrazione della soluzione standard di carbonato di calcio = 0.00412 mol/ 0.500 L=0.00824 M
Moli di carbonato di calcio in 25.0 mL = 0.00824 mol/L · 0.0250 L = 2.06 · 10-4 = moli di Ca2+ = moli di EDTA
Supponendo che siano stati utilizzati 19.6 mL di EDTA la sua concentrazione è pari a 2.06 · 10-4 /0.0196 L = 0.0105 M



