Mioglobina: struttura, funzioni
La mioglobina è una proteina globulare contenente il gruppo eme che si trova nelle cellule dei miociti del cuore e del muscolo scheletrico. È un’emoproteina citoplasmatica costituita da una singola catena polipeptidica di 154 amminoacidi.
Come l’emoglobina, la mioglobina si lega in modo reversibile all’ossigeno e quindi può facilitare il suo trasporto dai globuli rossi ai mitocondri durante i periodi di maggiore attività metabolica. Può inoltre fungere da serbatoio di ossigeno in condizioni ipossiche o anossiche.
Il biochimico Sir John Cowdery Kendrew, premio Nobel per la chimica nel 1962, scoprì la struttura di questa molecola oltre 40 anni fa.
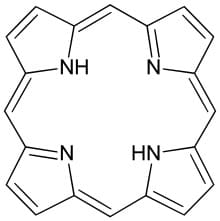
Le emoproteine sono metalloenzimi che costituiscono un’ampia classe di biomolecole coinvolte in una varietà di importanti reazioni biochimiche, come la conservazione e il trasporto di ligandi biatomici, la segnalazione cellulare, la catalisi enzimatica e il trasporto di elettroni.
Le emoproteine sono proteine contenenti una struttura porfirinica in cui è presente una struttura chimica complessa e sono costituite da quattro anelli di pirrolo legati tra loro tramite ponti metinici –CH=. I quattro atomi di azoto presenti al centro della molecola possono legarsi a uno ione metallico abitualmente di carica +2 o +3 come il ferro nell’emoglobina, il cobalto nella vitamina B12 e il magnesio nella clorofilla per formare stabili complessi organometallici.
Struttura della mioglobina

La mioglobina ha una struttura complessa ed è costituita da una catena polipeptidica composta da otto α-eliche al cui interno c’è un gruppo eme in grado di legare vari leganti tra cui ossigeno, monossido di carbonio e ossido nitrico. Il gruppo eme si trova tra due residui di istidina, His64 e His93. Lo ione ferro, presente nel gruppo eme interagisce con sei leganti, quattro dei quali sono forniti dagli atomi di azoto dei quattro piroli e condividono un piano comune.
La catena laterale di His93 fornisce il quinto legante, stabilizzando il gruppo eme e spostando leggermente lo ione ferro dal piano. La sesta posizione del ligando funge da sito di legame.
Funzioni
La mioglobina svolge tre ruoli fondamentali:
- fornire ossigeno ai muscoli rilasciandolo ai mitocondri che compongono la catena respiratoria.
- fungere da tampone delle concentrazioni di ossigeno intracellulare e da riserva di ossigeno nei muscoli
- diffondere ossigeno
Essa inoltre ha funzioni enzimatiche, è necessaria per la decomposizione dell’ossido nitrico bioattivo in nitrato la cui rimozione migliora la respirazione mitocondriale.
La mioglobina, inoltre, funziona per rimuovere le specie reattive dell’ossigeno interagendo con gli acidi grassi, che possono essere metabolicamente importanti in condizioni ossigenate e con un elevato fabbisogno energetico



