Idrogenasi: classificazione
Le idrogenasi sono enzimi catalizzano l’ossidazione reversibile dell’idrogeno molecolare e conseguentemente la riduzione dei substrati.
Questi enzimi appartengono quindi alla classe delle ossidoreduttasi catalizzando reazioni di ossidoriduzione. Tali reazioni avvengono con trasferimento di elettroni da un riducente ovvero una specie donatore di elettroni o di idrogeno a un’altra detta ossidante ovvero un accettore di elettroni.
La reazione di ossidazione dell’idrogeno è rappresentata come:
H2 ⇄ 2 H+ + 2 e–
Le idrogenasi sono al centro della ricerca per produrre idrogeno quale fonte energetica rinnovabile e non inquinante. Le idrogenasi catalizzano l’ ossidazione reversibile dell’idrogeno e consentono ai batteri di utilizzare l’idrogeno come fonte di energia per la loro crescita.
Sono al centro degli sforzi di ricerca volti a produrre H2 come vettore energetico rinnovabile e non inquinante, e attualmente vengono messi in risalto organismi come Chlamydomonas poiché hanno la capacità di accoppiare la produzione di H2 alla fotosintesi.
Questi enzimi hanno il potenziale per essere utilizzati per diverse applicazioni biotecnologiche, come la produzione di idrogeno in vitro da materiali rinnovabili e celle a combustibile a base di enzimi per la generazione di elettricità.
Classificazione delle idrogenasi
Sono metalloenzimi che, a seconda del tipo di sito metallico cataliticamente attivo si suddividono in idrogenasi [NiFe], [Fe-Fe], [Fe]. Le strutture cristallografiche delle idrogenasi di tutte e tre le classi sono state determinate a risoluzione atomica e hanno fornito informazioni sui possibili percorsi per il trasferimento di elettroni, protoni e molecole gassose come il diidrogeno.
Tutte e tre le classi contengono almeno un atomo di ferro nel sito attivo, che trasporta ligandi biatomici non proteici, come il monossido di carbonio e il cianuro e possono essere localizzate sia nella membrana cellulare che nel citoplasma
[NiFe]
La struttura ottenuta nel 1995 con spettri di diffrazione ai raggi X mostra due subunità. In una con massa molare maggiore è presente il sito attivo Ni-Fe in cui Fe è coordinato con leganti non proteici di cui uno costituito da CO e due da CN–.
Due residui di cisteina fanno da ponte tra i due metalli. Ni è coordinato dai residui di cisteina e un terzo legante a ponte si trova tra Ni e Fe
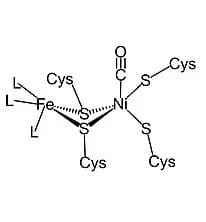
Le idrogenasi Ni-Fe, catalizzano sia la formazione che l’assorbimento dell’idrogeno, con citocromi come il citocromo c3, che agiscono come donatori o accettori di elettroni, a seconda del loro stato di ossidazione.
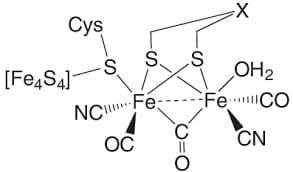
[FeFe]
Le [FeFe] idrogenasi catalizzano sia l’ ossidazione dell’idrogeno che la riduzione dei protoni ad idrogeno molecolare con significativa efficienza. Il sito attivo di queste proteine è costituito da un gruppo protesico con 6 atomi di ferro e 6 atomi di zolfo. Esse utilizzano un complesso organometallico unico, chiamato cluster H. Il cluster H è costituito da una struttura a forma di cubano [4Fe4S], accoppiata al cofattore di ferro a bassa valenza da un tiolo derivato dalla cisteina
[Fe]
Le [Fe] idrogenasi non contengono né nichel né cluster ferro-zolfo ma un cofattore contenente ferro.

A differenza di quelle [NiFe] e [FeFe] in cui gli elettroni si muovono una lunga distanza nelle [Fe] gli elettroni sono portati direttamente al sito attivo attraverso una breve distanza.



