5 esercizi sulle soluzioni tampone
Si propongono 5 esercizi sulle soluzioni tampone svolti e commentati. Le soluzioni tampone sono costituite da un acido debole e dalla sua base coniugata come acido acetico e acetato o da una base debole e dal suo acido coniugato come ammoniaca e ione ammonio. Le soluzioni tampone presentano la caratteristica di variare di poco il pH a seguito di aggiunta di piccole quantità di acido forte o di base forte.
Nella risoluzione degli esercizi sulle soluzioni tampone si fa generalmente uso dell’equazione di Handerson-Hasselbalch dovuta al chimico statunitense Lawrence Joseph Henderson e al chimico danese Karl Albert Hasselbalch.
L’equazione di Handerson-Hasselbalch correla il pH (ovvero il pOH) di una soluzione con la costante acida Ka dell’acido debole (ovvero con la costante basica Kb della base debole) con la concentrazione dell’acido debole e della sua base coniugata (ovvero della base debole e del suo acido coniugato).
L’equazione di Handerson-Hasselbalch per soluzioni tampone costituite da acido debole e base coniugata è:
pH = pKa + log [base coniugata]/[acido debole]
mentre per soluzioni tampone costituite da base debole e acido coniugato è:
pOH = pKb + log [acido coniugato]/[base debole]
essendo pKa = – log Ka e pKb = – log Kb
I 5 esercizi sulle soluzioni tampone sono presentati con grado di difficoltà crescente
5 esercizi sulle soluzioni tampone svolti e commentati
- Calcolare il pH di una soluzione tampone in cui la concentrazione di HNO2 è 0.250 M e la concentrazione di NaNO2 è 0.100 M sapendo che il valore di Ka dell’acido nitroso è 5.62 10-4
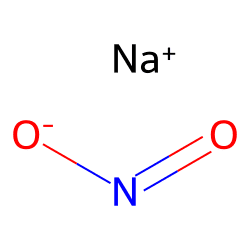
Il valore di pKa è pari a: pKa = – log 5.62 · 10-4 = 3.25
La concentrazione dello ione nitrito è pari a 0.100 M in quanto il nitrito di sodio è un elettrolita forte che si dissocia completamente nei suoi ioni.
Pertanto il pH della soluzione che si ottiene vale:
pH = 3.25 + log 0.100/0.250 = 2.85
- Calcolare la massa di NaNO2 che deve essere aggiunto a 250 mL di una soluzione 0.500 M di HNO2 per portare il pH al valore di 3.70 sapendo che il valore di Ka dell’acido nitroso è 5.62 10-4 e supponendo che, a seguito dell’aggiunta del nitrito di sodio, non si abbia variazione di volume
Il valore di pKa è pari a: pKa = – log 5.62 · 10-4 = 3.25
Applicando l’equazione di Henderson-Hasselbalch si ha:
3.70 = 3.25 + log [NO2–]/ 0.500
0.450 = log [NO2–]/ 0.500
Per le proprietà dei logaritmi e ricordando che il logaritmo presente nell’equazione di Henderson-Hasselbalch è in base 10 si ha:
100.450 = [NO2–]/ 0.500 = 2.82
moltiplicando ambo i membri per 0.500 si ottiene:
[NO2–] = 1.41 M
Le moli di NO2– che corrispondono alle moli di NaNO2 sono pari a:
Moli di NaNO2 = M · V = 1.41 · 0.250 L = 0.353
La massa di NaNO2 è quindi pari a 0.353 mol · 68.9953 g/mol = 2.44 g
- Calcolare la massa di cloruro di ammonio che deve essere aggiunta a 400 mL di una soluzione di NH3152 M per portare il pH al valore di 9.50 sapendo che il valore di Kb dell’ammoniaca è 1.80 · 10-5 e supponendo che, a seguito dell’aggiunta del cloruro di ammonio, non si abbia variazione di volume
Il valore del pOH è pari a 14 – 9.50 = 4.50
Il valore di pKb = – log Kb = – log 1.80 · 10-5 = 4.74
Applicando l’equazione di Henderson-Hasselbalch si ha:
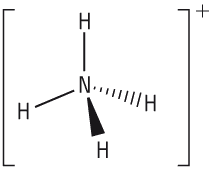
4.50 = 4.74 + log [NH4+]/ 0.152
Da cui: – 0.240 = log [NH4+]/ 0.152
Per le proprietà dei logaritmi e ricordando che il logaritmo presente nell’equazione di Henderson-Hasselbalch è in base 10 si ha:
10– 0.240 = [NH4+]/ 0.152 = 0.575
Moltiplicando ambo i membri per 0.152 si ottiene:
[NH4+] = 0.0874 M
Da cui le moli di ione ammonio che corrispondono alle moli di cloruro di ammonio sono pari a:
0.0874 mol/L · 0.400 L =0.0350
La massa di cloruro di ammonio vale quindi: 0.0350 mol · 53.941 g/mol = 1.89 g
- Calcolare il pH di una soluzione ottenuta mescolando 50.0 mL di acido acetico 0.100 M e 5.00 mL di idrossido di sodio 0.150 M sapendo che il pKa dell’acido acetico vale 4.74. Si suppongano i volumi additivi
Le moli di acido acetico sono pari a 0.0500 L · 0.100 mol/L = 0.00500
L’acido acetico reagisce con l’idrossido di sodio secondo la reazione di neutralizzazione:
CH3COOH + NaOH → CH3COONa + H2O
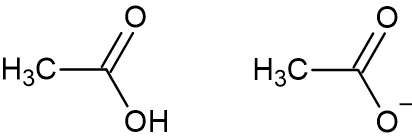
Le moli di NaOH sono pari a 0.00500 L · 0.150 mol/L = 0.000750
Le moli di acido acetico che rimangono in eccesso a seguito della neutralizzazione sono pari a 0.00500 – 0.000750 = 0.00425 e le moli di acetato di sodio formate sono 0.000750.
Il volume totale è pari a 50.0 + 5.00 = 55.0 mL = 0.0550 L
Pertanto la concentrazione dell’acido è 0.00425/0.0550 = 0.0773 M mentre quella dell’acetato è 0.000750/0.0550 = 0.0136 M
Il pH della soluzione tampone è pari a: pH = 4.74 + log 0.0136/0.0773 = 3.99
- Calcolare il volume di una soluzione di KHSO3150 M e il volume di una soluzione di K2SO3 0.750 M necessari per ottenere 100 mL di una soluzione tampone a pH = 7.00 sapendo che il valore di Ka2 dell’acido solforoso è pari a 6.76 · 10-8
Il valore di pKa2 = – log Ka2 = – log 6.76 · 10-8 = 7.17
Detto V1 il volume della soluzione di KHSO3 e detto V2 il volume della soluzione di K2SO3 si ha:
V1 + V2 = 100 mL = 0.100 L (1)
Applicando l’equazione di Handerson-Hasselbalch si ha:
7.00 = 7.17 + log [SO32-]/[HSO3–]
da cui si ottiene 7.00 – 7.17 = – 0.17 = log [SO32-]/[HSO3–]
Per le proprietà dei logaritmi e ricordando che il logaritmo è in base 10:
10-0.17 = [SO32-]/[HSO3–] =0.676 (2)
La concentrazione di SO32- è pari alle moli di SO32-/0.100 L e quella di HSO3– è pari alle moli di HSO3–/0.100 L. Pertanto il rapporto [SO32-]/[HSO3–] può essere scritto come moli di SO32-/0.100 L/ moli di HSO3–/0.100 L = moli di SO32-/ moli di HSO3–.
Per definizione moli = molarità · Volume quindi: moli di HSO3– = 0.150 V1 e moli di SO32- = 0.750 V2
Dalla (1) V1= 0.100 – V2 quindi moli di HSO3– = 0.150 (0.100 – V2) = 0.0150 – 0.150 V2
Sostituendo nella (2) si ha:
0.676 = 0.750 V2/0.0150 – 0.150 V2
Moltiplicando ambo i membri per 0.0150 – 0.150 V2 si ottiene:
0.0101 – 0.101 V2 = 0.750 V2
ovvero 0.0101 = 0.851 V2
Da cui V2 = 0.0119 L = 11.9 mL e quindi V1 = 100 – 11.9 =88.1 mL



