Orbitali di tipo p: numeri quantici
Calcoli matematici e evidenze sperimentali indicano che gli orbitali p hanno due lobi con fase opposta indicate con il segno + e – rispettivamente a causa della presenza di un piano nodale ovvero di un piano su cui l’elettrone ha probabilità nulla di esistenza situato all’intersezione degli assi.
Un orbitale è la regione dello spazio in cui vi è una probabilità maggiore del 90% di trovare l’elettrone.
Secondo il principio di indeterminazione di Heisenberg, non possono essere determinati simultaneamente la posizione e la quantità di moto dell’elettrone.
Numeri quantici
Gli orbitali p sono caratterizzati dall’avere il numero quantico secondario l pari a 1 e pertanto l’orbitale p con minore energia è l’orbitale 2p.
Poiché i valori del numero quantico magnetico m vanno da -l a +l compreso lo zero quando l = 1 vi sono tre numeri quantici magnetici che assumono, rispettivamente, valori -1, 0 e +1.
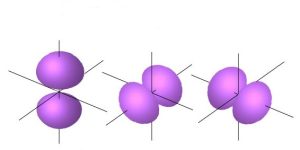
Si individuano così tre orbitali p aventi la stessa energia ovvero degeneri che vengono chiamati px, py e pz.
Questi tre orbitali p sono perpendicolari tra loro essendo px simmetrico rispetto all’asse x, py simmetrico rispetto all’asse y e pz simmetrico rispetto all’asse z.
L’energia di un orbitale 2p è di poco maggiore rispetto a quella di un orbitale 2s.
Configurazione elettronica
Un orbitale p può contenere un massimo di sei elettroni secondo il principio di esclusione di Pauli e questi elettroni, nel caso di un orbitale 2p, sono caratterizzati dall’avere i seguenti numeri quantici:
| 2 | 1 | – 1 | + ½ |
| 2 | 1 | – 1 | – ½ |
| 2 | 1 | 0 | + ½ |
| 2 | 1 | 0 | – ½ |
| 2 | 1 | +1 | -+½ |
| 2 | 1 | +1 | – ½ |
Pertanto la configurazione elettronica del neon che ha 10 elettroni è 1s2, 2s2, 2p2.
I tre elettroni dell’azoto presenti nell’orbitale 2p si distribuiscono uno in px, uno in py e uno in pz secondo la regola di Hund e i loro numeri quantici sono:
| 2 | 1 | – 1 | + ½ |
| 2 | 1 | 0 | + ½ |
| 2 | 1 | +1 | +½ |



