Le toluidine sono composti organici aromatici aventi formula C7H9N costituite da un anello benzenico a cui sono legati il gruppo –NH2 e il gruppo –CH3. A seconda della posizione reciproca dei due sostituenti si hanno 3 possibili isomeri comunemente noti come o-toluidina (2-ammino-1-metilbenzene) , m-toluidina (3-ammino-1-metilbenzene) , p-toluidina (4-ammino-1-metilbenzene)

Proprietà delle toluidine
Le proprietà chimiche delle toluidine sono simili a quelle dell’anilina e, a causa della presenza del gruppo amminico, le toluidine mostrano proprietà debolmente basiche. Sono poco solubili in acqua ma la loro solubilità aumenta in soluzione acida a causa della formazione di sali di ammonio. Gli isomeri orto e meta sono liquidi viscosi mentre l’isomero para è solido a causa del fatto che la le molecole di p-toluidina sono più simmetriche rispetto alle altre e sono più idonee ad adattarsi a una struttura cristallina.
Le toluidine vengono usate nell’industria dei coloranti, nell’industria farmaceutica e addizionate come acceleranti nelle colle cianoacriliche.
Sintesi
La sintesi della m-toluidina è condotta in modo diverso rispetto a quella degli altri due isomeri infatti sia il gruppo amminico –NH2 che il gruppo metilico –CH3 sono attivanti e orto/para direttori quindi partendo dall’anilina o dal toluene l’ulteriore sostituzione avverrebbe in orto o in para e pertanto si deve ricorrere a un’altra strategia di sintesi. Si deve quindi introdurre un gruppo diverso da –NH2 o –CH3 che sia un meta direttore e che possa essere successivamente trasformato.
Il nitro gruppo –NO2 può costituire una buona soluzione in quanto esso è meta direttore e può essere successivamente ridotto. Si fa quindi una nitrazione del benzene in presenza di HNO3 e H2SO4
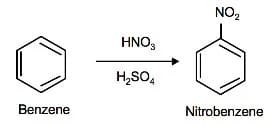
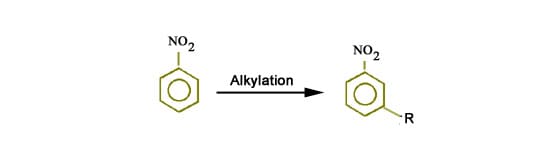
Per ottenere il nitrobenzene e poi si procede ad un’alchilazione di Friedel Craft in presenza di AlCl3 e CH3Cl
La successiva reazione di riduzione del 3-nitro-1-metilbenzene in presenza di Sn e HCl porta al prodotto desiderato:

Per quanto attiene la sintesi dell’ o-toluidina e della p-toluidina si parte sempre dal benzene che, per nitrazione dà il nitrobenzene che viene ridotto a ione fenilammonio in presenza di Sn e HCl secondo la semireazione di riduzione:
C6H5NO2 + 7 H+ + 6 e– → C6H5NH3+ + 2 H2O
La reazione del fenilammonio con idrossido di sodio dà luogo alla formazione di anilina:
C6H5NH3+ + OH– → C6H5NH2 + H2O
L’anilina contenendo il gruppo –NH2 attivante e orto, para direttore può a questo punto subire un’alchilazione di Friedel-Craft per dare i due isomeri o-toluidina e m-toluidina.
Usi
L’o-toluidina viene utilizzata come intermedio nella sintesi degli erbicidi come metolacloro e acetochlor, nella produzione di oltre 90 coloranti e pigmenti, come intermedio per gomma sintetica e prodotti chimici per la vulcanizzazione della gomma, prodotti farmaceutici e pesticidi.
L’isomero para subisce una reazione di accoppiamento ossidativo con la catecolammina per formare un colorante arancione solubile in acqua ed è stata utilizzata nella preparazione di:
azocomposti aromatici ligandi bidentati a base di Schiff tramite condensazione con salicilaldeide
