Acidità di composti organici: effetto induttivo, risonanza
L’acidità di composti organici come gli acidi carbossilici è data dalla tendenza dell’acido a cedere il protone ad un opportuno accettore. Un riferimento per conoscere l’acidità di composti organici è la costante di equilibrio o il pKa
Quanto più è elevato il valore di pKa di un determinato acido tanto maggiore è la forza della sua base coniugata.
I fattori strutturali che possono stabilizzare la base coniugata e, quindi, la forza dell’acido sono essenzialmente i seguenti:
- Effetti di risonanza
- effetti induttivi ed elettrostatici
- ibridazione
- Possibilità di formazione di legami a idrogeno
- effetti sterici
Effetti di risonanza
Tali effetti sono di gran lunga i più importanti: la loro presenza o meno può far variare la forza degli acidi di diverse unità di pKa . Gli acidi carbossilici RCOOH il cui anione è stabilizzato dalla risonanza sono acidi molto più forti dei corrispondenti alcoli RCH2OH in cui la sostituzione del carbonile con un gruppo metilenico impedisce qualunque stabilizzazione della carica negativa per risonanza:
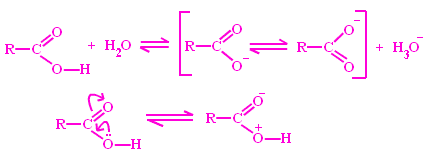
Un acido carbossilico ha un valore di pKa intorno a 5 mentre un alcol il cui anione non è stabilizzato per risonanza:
R-CH2-OH ⇆ R-CH2-O– + H+
Ha un valore di pKa intorno a 17
L’equivalenza energetica della strutture che contribuiscono all’ibrido ha grande importanza nel determinare l’energia di risonanza di un sistema e quindi, nel caso di acidi protici, nel determinare la stabilità dell’anione.
Considerazioni analoghe a quelle fatte per gli acidi carbossilici possono essere fatte per confrontare la diversa basicità delle ammine aromatiche e alifatiche. L’anilina, ad esempio, è una base molto più debole della metilammina: l’anilina, infatti, è stabilizzata per risonanza mentre lo ione anilinio non lo è.
Le strutture di risonanza vengono che mostrate in figura
illustrano come mentre l’anilina è stabilizzata per risonanza e pertanto tale effetto stabilizza più la base libera che non il suo acido coniugato, la metilammina non è stabilizzata per risonanza e pertanto esibisce un comportamento più basico.
La presenza di un gruppo elettronattrattore quale, ad esempio, il nitrogruppo, in posizione orto o para ha l’effetto di abbassare ulteriormente il valore del pKa in quanto il doppietto elettronico solitario presente sull’azoto, responsabile della basicità, risulta ancor meno disponibile trovandosi delocalizzato all’interno dell’anello benzenico.
Effetti induttivi e acidità di composti organici
A differenza dell’effetto mesomero, relativamente insensibile alla distanza dal centro della reazione, l’effetto induttivo, dovuto all’esistenza di dipoli permanenti o alla polarizzabilità di certi gruppi, dipende molto dalla distanza. Il diverso valore di pKa negli acidi α,β e γ-clorobutirrici è indicativo di questo fatto.
La presenza di effetti induttivi può portare a una considerevole modificazione delle proprietà acide e basiche di determinati gruppi. E’ questo il caso dell’acido trifluoroacetico e del β- trifluoroetilammonio. In entrambi i casi la dissociazione del protone avviene molto più facilmente di quanto non avvenga negli acidi in cui i tre atomi di fluoro siano stati sostituiti da atomi di idrogeno:
CH3COOH ⇆ CH3COO– + H+ pKa = 4.8
CF3COOH ⇆ CF3COO– + H+ pKa = 0.3
CH3-CH2-N+H3 ⇆ CH3-CH2-NH2 + H+ pKa = 10.5
CF3-CH2-N+H3 ⇆ CF3-CH2-NH2 + H+ pKa = 7.5
Legami a idrogeno
La possibilità di formare legami a idrogeno intramolecolari può influenzare notevolmente la forza di un acido o di una base. Se il legame a idrogeno stabilizza la base coniugata più dell’acido libero ne risulta un aumento della forza dell’acido, mentre in caso contrario la forza dell’acido è diminuita. L’acido o-idrossibenzoico è così circa 1.5 unità di pKa più forte dell’acido p-idrossibenzoico, a causa della stabilizzazione della base coniugata a seguito della formazione del legame a idrogeno che avviene nell’isomero orto tra l’idrogeno alcolico del gruppo –OH e l’ossigeno del gruppo carbossilico.
Effetti sterici
Generalmente i processi in cui il protone viene trasferito da un atomo all’altro non sono influenzati dalla presenza o meno di gruppi ingombranti intorno alla zona interessata alla reazione. Il protone è sufficientemente piccolo da non modificare apprezzabilmente, da un punto di vista sterico, il contenuto energetico di un sistema. L’effetto dovuto all’impedimento sterico è più sensibile con gli acidi di Lewis, più ingombranti.
Effetti sterici, possono, però avere un certo influsso sulla basicità o acidità di composti aromatici influenzando la risonanza. Un anione viene stabilizzato dalla sua coniugazione con un gruppo dotato di un effetto mesomero – M. Affinché la risonanza possa avere il suo massimo effetto è che la zona interessata alla delocalizzazione sia coplanare, cioè che lo scheletro σ del sistema insaturo sia piano.
Allora l’introduzione di un sostituente che impedisce la coplanarità tra il centro interessato alla reazione acido-base e il gruppo dotato di effetto + M o – M deve risolversi in una modificazione delle caratteristiche acide e basiche del sistema. Infatti il 3,5-dimetil-4-nitrofenolo è un acido meno forte del 4-nitrofenolo a causa della vicinanza tra i due metili e il gruppo nitro e della conseguente rotazione di quest’ultimo intorno al legame carbonio-azoto che rende una struttura più significativa dell’altra.
Ibridazione
La disponibilità di un doppietto elettronico alla formazione di un legame con il protone dipende dalla percentuale di carattere s e p dell’orbitale: la basicità aumenta all’aumentare con l’aumentare del carattere p. Un doppietto elettronico su un orbitale sp3 è così più basico di un doppietto elettronico su un orbitale sp2 a sua volta più basico di un doppietto elettronico su un orbitale sp. Questo fatto è messo in evidenza dal confronto dei pKa per l’etano, l’etene e l’etino:
CH3-CH3 → CH3-CH2– + H+ pKa = 42
CH2=CH2 → CH2=CH– + H+ pKa = 36
CH≣CH → CH≣C– + H+ pKa = 25





