Titanato di bario: struttura, proprietà
Il titanato di bario BaTiO3 è un composto inorganico sintetizzato per riscaldamento del biossido di titanio TiO2 e carbonato bario BaCO3 che si presenta sotto forma di una polvere bianca a struttura perovskitica che varia a seconda della temperatura.
La scoperta degli effetti piezoelettrici nella ceramica di titanato di bario elettricamente polarizzata, all’inizio del 1940, fu un contributo rivoluzionario all’arte dei trasduttori elettromeccanici.
Le ceramiche di titanato di bario furono scoperte durante la seconda guerra mondiale indipendentemente in quattro paesi: Stati Uniti, Giappone, Russia e Germania intorno al 1944
Struttura del titanato di bario
Nella fase cubica, stabile tra i 120 e i 1460°C vi è un arrangiamento cubico compatto di Ba2+ e O2- con Ti4+ posti in siti ottaedrici.
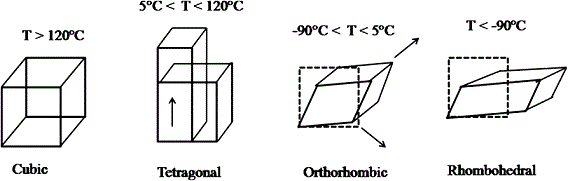
A temperature comprese tra 5 e 120°C si presenta in forma tetragonale, tra – 90 e 5°C in forma ortorombica e a temperature inferiori a – 90°C in forma romboedrica.
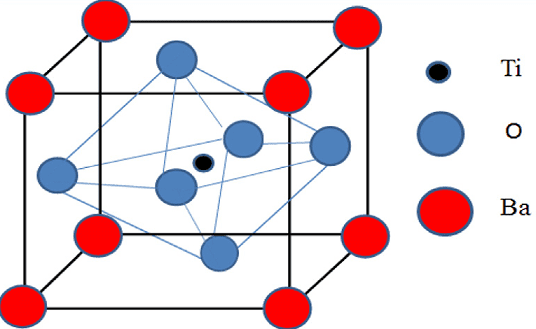
Con il termine di perovskiti sono indicati composti che hanno struttura ABO3 detti ossidi ternari essendo, in genere:
- A un metallo alcalino-terroso
- B un metallo di transizione come cobalto, titanio e manganese.
La composizione del titanato di bario è solitamente ricca di biossido di titanio. Tale composizione ha un punto eutettico a circa 1320 °C, rendendo possibile la sinterizzazione al di sotto di 1350 °C. Per il titanato di bario stechiometrico , i cationi sostitutivi che hanno una valenza maggiore di quelli che sostituiscono, ad esempio La3+ al posto di Ba2+ o Nb5+ al posto di Ti4+, sono chiamati cationi donatori.
Il titanato di bario è un cristallo ferroelettrico ovvero dotato di elevatissima costante dielettrica. In esso permane una polarizzazione residua anche dopo la rimozione del campo elettrico esterno inducente.
Il fenomeno della ferroelettricità è stato scoperto in materiali monocristallini del sale di Rochelle nel 1921.
Le due condizioni necessarie per classificare un materiale come ferroelettrico sono:
- l’esistenza di polarizzazione spontanea
- un riorientamento di polarizzazione.
Le regioni polarizzate, con una singola direzione di polarizzazione, sono chiamati domini.
Proprietà
Il titanato di bario puro ha una resistività dell’ordine di 1012 Ω ∙ cm a temperatura ambiente e quindi si comporta da isolante elettrico. Se viene dopato con alcuni metalli come scandio, ittrio, neodimio e samario, il valore della resistività cala a 103 Ω ∙ cm. Il materiale dopato inizialmente ha una diminuzione della resistività all’aumento della temperatura fino alla temperatura di 120°C che costituisce, per il titanato di bario, il punto di Curie.
A questa temperatura la resistività aumenta rapidamente all’aumentare della temperatura fino a raggiungere un valore massimo. Esso varia a seconda del dopante aggiunto ed è di circa quattro volte rispetto a quello trovato a temperatura ambiente per poi decrescere nuovamente.
Per queste sue caratteristiche il titanato di bario può essere utilizzato nei dispositivi switching. Essi sono quei dispositivi in grado di aprire o chiudere uno o più circuiti elettrici. Inoltre il titanato di bario è usato nei termistori ovvero resistori in cui il valore della resistenza varia al variare della temperatura.
Il titanato di bario esibisce inoltre l’effetto fotorifrattivo per il quale, se esposto alla luce si verifica una variazione locale dell’indice di rifrazione. Questa proprietà della luce può essere utilizzata per realizzare degli strumenti ottici come gli specchi a coniugazione di fase, i calcolatori ottici, gli interruttori ottici, gli ologrammi dinamici e, soprattutto, le memorie olografiche.
Il titanato di bario presenta il fenomeno della piezoelettricità per il quale se si esercita una pressione, lungo una opportuna direzione, si produce una separazione di cariche elettriche, positive da una parte e negative dall’altra.
Il titanato di bario è insolubile in acqua e in alcali ma è solubile in molti acidi tra cui l’acido cloridrico e si solubilizza completamente in acido fluoridrico e acido solforico.



