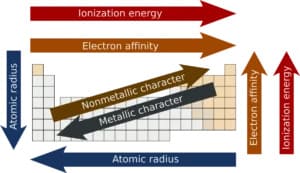
Proprietà periodiche
La periodicità delle proprietà degli elementi consente di confrontare, in base della posizione dell’elemento, alcune grandezze dette proprietà periodiche.
Il fisico inglese Henry G. Moseley ( 1887- 1915) stabilì sperimentalmente che le proprietà degli elementi sono funzione del loro numero atomico e non della loro massa. Talune proprietà si ripresentano periodicamente mano a mano che aumenta il numero atomico: si può ritenere verosimile che il progressivo riempimento degli orbitali sia responsabile di tale fenomeno.
Le proprietà periodiche
Energia di ionizzazione
Tra le proprietà periodiche vi è l’energia di ionizzazione è l’energia minima necessaria ad allontanare un elettrone da un atomo in fase gassosa che, a seguito della somministrazione di tale energia, diventa ione positivo. Ovvero:
X (gas) = X+ + 1 e–
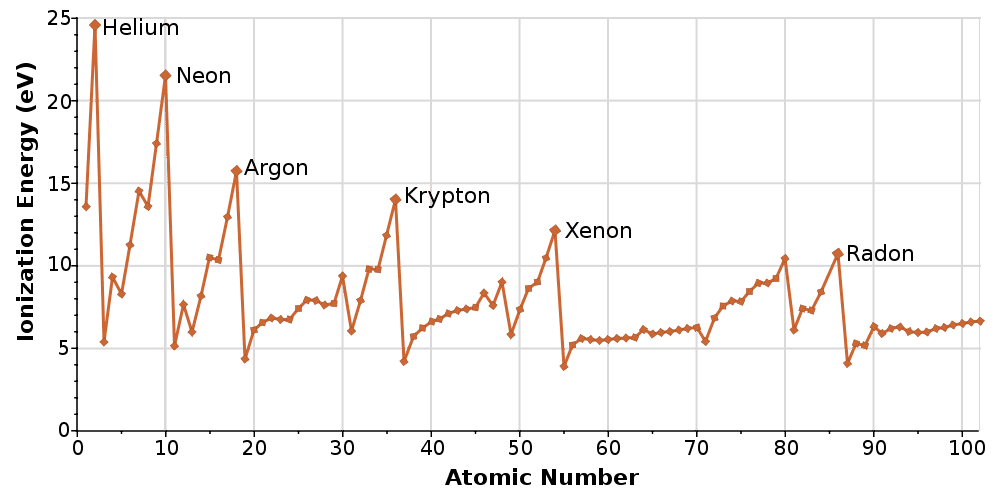
Tale energia di prima ionizzazione è nota anche come potenziale di ionizzazione. L’andamento delle energie di ionizzazione è riportato in figura:
A parte apparenti irregolarità si può affermare che l’energia di ionizzazione aumenta da destra a sinistra lungo un periodo e dal basso verso l’alto lungo un gruppo come può essere rilevato dalla seguente figura:
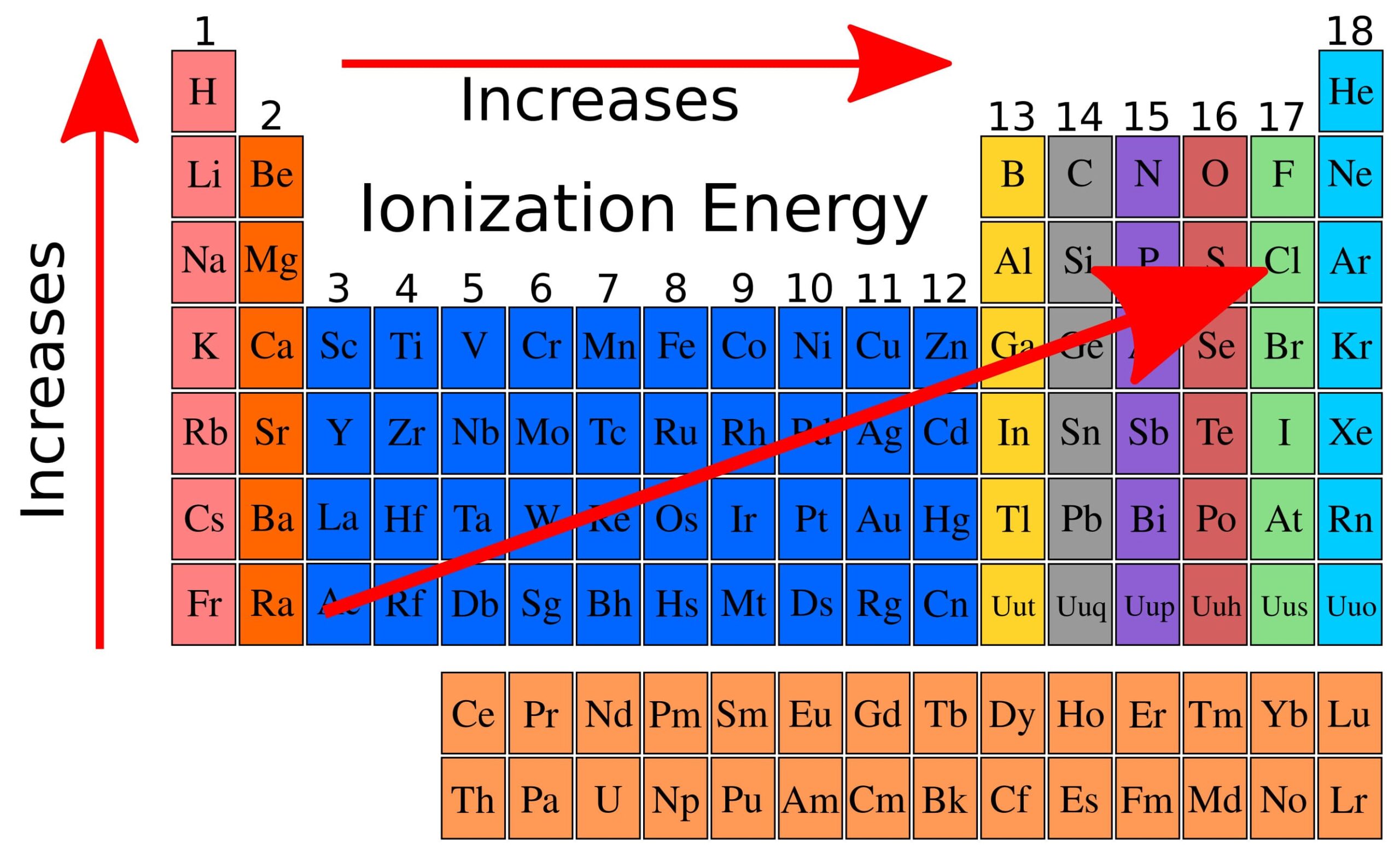
il valore più basso di energia di ionizzazione si riscontra nel vertice inferiore sinistro della tavola periodica in corrispondenza del cesio, mentre il valore più elevato si ha nel vertice superiore destro in corrispondenza dell’elio. Si può quindi prevedere che gli elementi dotati di bassa energia di ionizzazione diano ioni positivi con maggiore facilità.
L’energia di ionizzazione aumenta dal basso verso l’alto lungo un gruppo in quanto l’elettrone più esterno occupa progressivamente uno più vicino al nucleo risultandone, pertanto, maggiormente attratto. L’energia di ionizzazione aumenta da sinistra verso destra lungo un periodo in quanto l’elettrone esterno subisce una maggiore attrazione stante la maggiore carica nucleare effettiva. Esistono, inoltre energie di seconda e terza ionizzazione, relative alle seguenti reazioni:
X+ = X2+ + 1 e–
X2+ = X3+ + 1 e–
Per un dato atomo le energie di seconda e terza ionizzazione sono sempre maggiori rispetto alla prima e ciò è in relazione al fatto che la rimozione di una carica negativa diventa più difficile mano a mano che aumenta la carica positiva della specie stessa: occorre, infatti, più energia per allontanare un elettrone da uno ione positivo che da un atomo.
Affinità elettronica
L’affinità elettronica è l’energia in gioco quando un elettrone si lega a un atomo in fase gassosa secondo la reazione:
X(gas) + 1 e– = X–(gas)
Una elevata affinità elettronica vuol dire che tale processo si accompagna alla liberazione di una grande quantità di energia. Invece un’affinità elettronica negativa vuol dire che per importare l’ elettrone all’atomo occorre spendere energia. In modo più formale l’affinità elettronica si definisce come:
Eae = E(X) – E(X–) dove E(X) rappresenta l’energia dell’atomo X mentre E(X–) rappresenta l’energia dello ione X– considerati entrambi in fase gassosa. La figura mostra i valori dell’affinità elettronica di alcuni elementi.
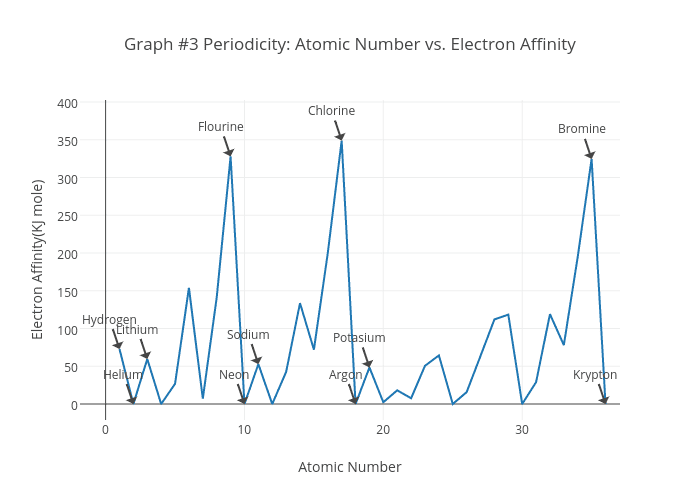
Si tratta di una grandezza il cui carattere periodico è meno spiccato rispetto a quello delle altre proprietà periodiche, ma ciò non toglie che si manifesti una tendenza generale:
Gli alogeni hanno la più alta affinità elettronica perché manca loro un solo elettrone per raggiungere la configurazione elettronica del gas nobile successivo; d’altra parte l’alto potenziale di ionizzazione degli alogeni indica che gli elettroni np sono fortemente legati agli atomi e, quindi, è ragionevole pensare che un ulteriore elettrone risenta abbastanza fortemente dell’attrazione nucleare
Agli alogeni seguono ossigeno e zolfo per ragioni analoghe
I metalli alcalini hanno bassa affinità elettronica in accordo con il fatto che già l’ultimo elettrone dell’atomo neutro nell’orbitale ns non è fortemente legato al nucleo
In generale l’affinità elettronica aumenta da sinistra verso destra lungo un periodo e dal basso verso l’alto lungo un gruppo come può essere rilevato dalla figura:

Raggio atomico
Le nubi elettroniche non hanno confini netti il che vieta di parlare di raggio dell’atomo. Quando gli atomi si organizzano nei solidi o nelle molecole, i loro centri si trovano a distanze definite gli uni dagli altri e quindi riconosciamo come raggio atomico la metà della distanza tra i nuclei di atomi contigui come si può vedere in figura:

In generale il raggio atomico diminuisce da sinistra verso destra lungo i periodi e aumenta dall’alto verso il basso lungo un gruppo:
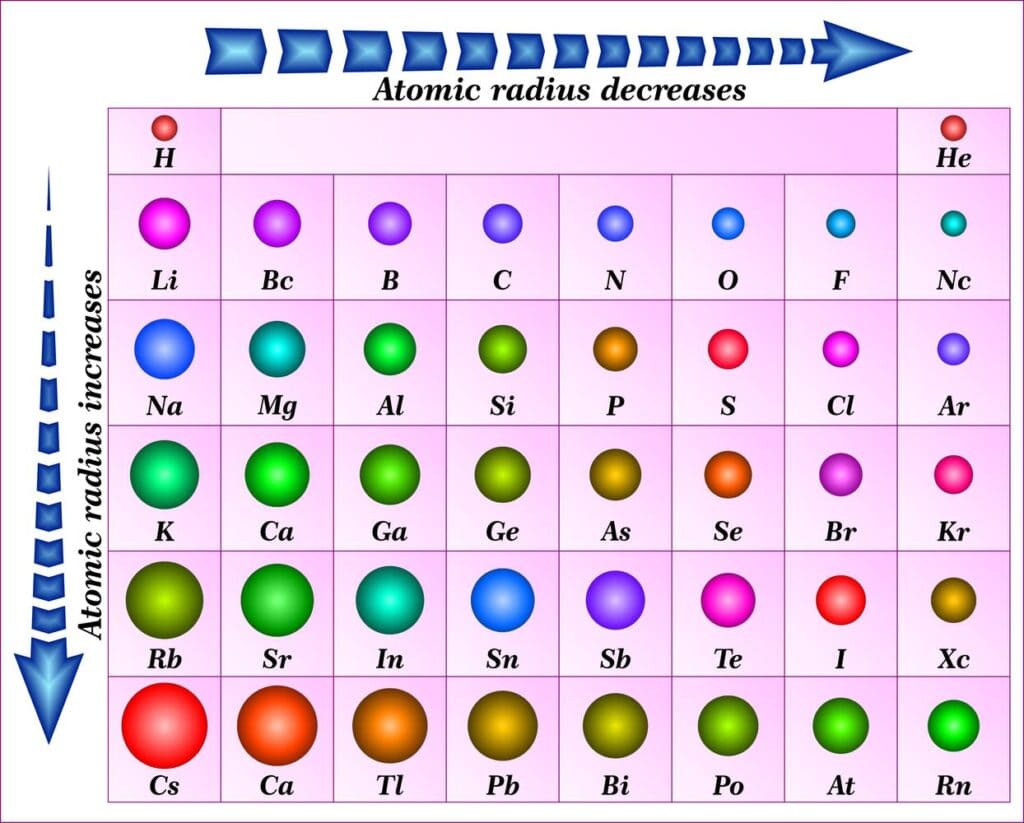
l’aumento del raggio atomico che si registra scendendo dall’alto verso il basso lungo un gruppo è intuitivo in quanto gli elettroni esterni occupano strati via via più lontani dal nucleo. Quello che può sorprendere, invece, è la diminuzione dello stesso da sinistra a destra lungo un periodo.
La spiegazione sta nel fatto che gli elettroni vanno aggiungendosi nello stesso strato e, quindi, più o meno alla stessa distanza dal nucleo rispetto a quelli preesistenti, ma poiché lungo un periodo la carica nucleare effettiva aumenta gli elettroni vengono maggiormente attratti con conseguente contrazione del raggio atomico.
Elettronegatività
Tra le proprietà periodiche quella più importante è l’elettronegatività per la quale il chimico americano Linus Pauling nel 1932 ne propose una misura quantitativa. L’elettronegatività χ è la tendenza di un atomo ad attrarre a sé elettroni di legame.
L’atomo dell’elemento dotato di maggiore elettronegatività ha un maggiore potere di attrazione nei confronti degli elettroni tendendo a sottrarli all’elemento dotato di elettronegatività minore. La maniera più semplice per stabilire una scala di elettronegatività si deve a Robert Mulliken che definì l’elettronegatività come la semisomma dell’energia di ionizzazione e dell’affinità elettronica:
χ = I + Eae/2
La figura mostra la variazione dell’elettronegatività degli elementi:
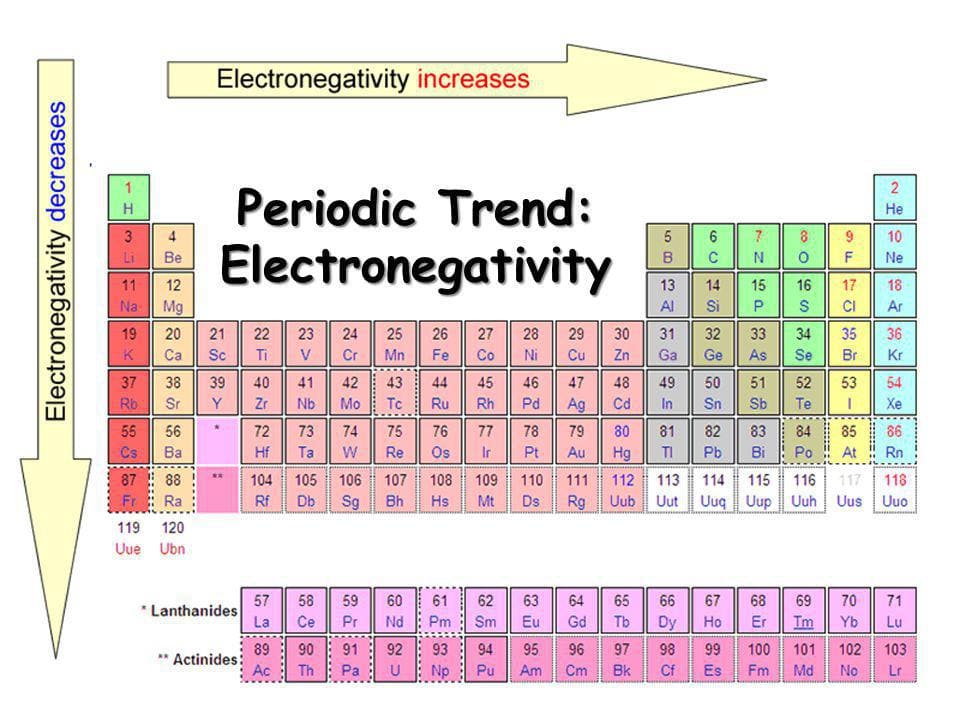
Si rileva che l’elettronegatività aumenta da sinistra a destra lungo un periodo e dal basso verso l’alto lungo un gruppo:
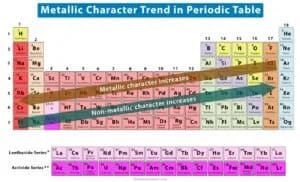
Carattere metallico
Il carattere metallico è utilizzato per definire alcune proprietà chimiche in quanto, in genere, i metalli tendono a perdere elettroni per formare cationi, mentre i non metalli tendono ad acquistare elettroni per formare anioni. Inoltre i metalli tendono a formare ossidi basici: maggiore è il carattere metallico, maggiore è la basicità dell’ossido. Al contrario dei non metalli che tendono a formare ossidi acidi. Il carattere metallico decresce da sinistra a destra lungo un periodo e dal basso verso l’alto lungo un gruppo.
Conclusione
In figura sono rappresentati i trends delle proprietà periodiche: