Principio di elettroneutralità: applicazioni
Il principio di elettroneutralità è utilizzato per:
- prevedere quale tra le strutture di risonanza di una molecola o di uno ione poliatomico sia quella più significativa
- spiegare l’esistenza di legami π nei composti o negli anioni contenenti silicio, fosforo o zolfo legati a un atomo di ossigeno.
Il principio di elettroneutralità, che ha svolto un ruolo importante nello studio della struttura molecolare, fu pubblicato nel 1948 dal chimico statunitense Linus Carl Pauling secondo il quale le molecole stabili e i cristalli hanno strutture elettroniche tali che la carica elettrica di ogni atomo è vicina allo zero e comunque compresa in un range tra -1 e +1.
Stabilità dei complessi inorganici
Il principio tende inoltre a spiegare la stabilità dei complessi inorganici. Nel legame presente nei composti di coordinazione una coppia di elettroni viene messa a disposizione da un solo atomo mentre l’altro atomo non utilizza elettroni propri ma sfrutta la coppia elettronica del primo atomo.
Il donatore di elettroni è detto legante ed è spesso indicato con L mentre l’atomo accettore indicato spesso con M è lo ione metallico.
Un legame coordinato può quindi essere indicato come M←L. Sulla base di queste considerazioni esposte dal chimico britannico Nevil Sidgwick nel 1927 lo ione complesso esammino cobalto (III) [Co(NH3)6]3+ può essere rappresentato dalla seguente struttura:
Secondo questa teoria ogni atomo di azoto dona uno dei suoi due elettroni che costituiscono il doppietto elettronico solitario allo ione Co3+ che, legandosi a sei molecole di ammoniaca assume carica -3.
Un tale accumulo di carica negativa sul cobalto appare tuttavia inverosimile. Si potrebbe allora ipotizzare un modello ionico in cui la carica +3 rimane localizzata sul cobalto e i sei leganti rimangono neutri.
Tuttavia evidenze sperimentali dimostrano che il complesso, in soluzione acquosa, rimane come un’unica entità. Le interazioni elettrostatiche implicite in questo modello sono improbabili che siano abbastanza forti da permettere che ciò accada.
Pauling suggerì che si potesse assumere che nel legame tra cobalto e ammoniaca vi fosse un parziale carattere ionico. Applicando il principio di elettroneutralità per il quale idealmente la carica netta sul metallo centrale deve essere pari a zero si può ipotizzare che lo ione cobalto può accettare tre elettroni dai sei leganti. Pertanto secondo tale principio il legame tra lo ione cobalto e ciascuna molecola di ammoniaca ha il 50% di carattere ionico e il 50% di carattere covalente.
Applicazioni
Oltre che spiegare la stabilità dei composti di coordinazione il principio dell’elettroneutralità consente di spiegare i contributi delle strutture di risonanza e le strutture presenti in alcune molecole. Ad esempio le possibili strutture dello ione tiocianato sono: 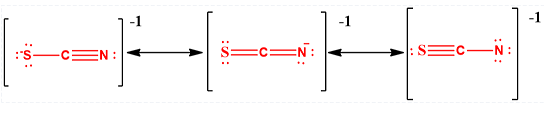
Nella prima delle tre strutture la carica formale di S è -1 mentre quelle sia del carbonio che dell’azoto sono pari a zero. La terza struttura presenta lo zolfo con carica formale +1, il carbonio zero e l’azoto -2. Nella seconda struttura lo zolfo e il carbonio hanno carica formale zero e l’azoto -1. Quest’ultima struttura è la più stabile perché, in accordo con il principio di elettroneutralità minimizza il numero di cariche formali. Inoltre la carica negativa è presente sull’elemento più elettronegativo.
Tuttavia, le moderne tecniche computazionali individuano molti composti stabili che presentano una distribuzione di carica maggiore rispetto a quanto previsto dal principio di elettroneutralità. Inoltre, con l’avvento delle nanotecnologie è si è compresa l’importanza delle dimensioni e molte proprietà di una sostanza possono cambiare con la dimensione.
Nel 1970 tale principio, alla luce di alcune possibili deviazioni è stato così enunciato: “Le molecole e i cristalli stabili hanno strutture elettroniche tali che la carica elettrica di ciascun atomo è prossima allo zero. ”




