L’equilibrio chimico: reazione diretta e inversa
L ‘equilibrio chimico è caratterizzato da reazioni che non avvengono completamente per cui, quando si forma una certa quantità di prodotto esso coesiste con il reagente. Tali reazioni dette di equilibrio o reversibili sono rappresentate con una doppia freccia ⇄ .
Per chiarire quanto accade in una reazione reversibile consideriamo la reazione per la quale si ottiene ioduro di idrogeno a partire dai gas componenti H2 e I2:
H2(g) + I2(g) ⇄ 2 HI(g)
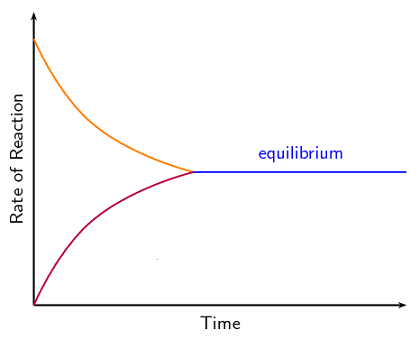
All’inizio la reazione di sintesi ( reazione diretta) avviene rapidamente poiché la concentrazione dei reagenti è molto elevata e quindi la possibilità di urti è massima.
A mano a mano che la reazione procede la concentrazione dei reagenti diminuisce e con essa la velocità della reazione stessa. Lo ioduro di idrogeno inizia a formarsi rapidamente e si decompone, a sua volta, nei gas componenti: avviene cioè la reazione opposta ( reazione inversa) che diviene via via sempre più veloce al crescere della concentrazione molare di HI.
Una reazione di equilibrio chimico si contrappone a quelle come la combustione che sono irreversibili e che giungono, in un tempo più o meno lungo a completezza
Equilibrio dinamico
Quando la reazione diretta e la reazione inversa avvengono con la stessa velocità il numero di particelle di HI che si formano nell’unità di tempo è pari al numero di particelle di HI che si decompongono: il sistema si trova in un equilibrio dinamico in cui i tre gas coesistono e la loro concentrazione si mantiene costante.
Consideriamo ora la generica reazione di equilibrio:
aA + bB ⇄ cC + dD
tale reazione può essere scomposta nelle due reazioni che avvengono simultaneamente:
aA + bB → cC + dD reazione diretta
cC + dD → aA + bB reazione inversa
Secondo le leggi della cinetica chimica la velocità della reazione è direttamente proporzionale alla concentrazione dei reagenti ciascuno elevato al proprio coefficiente stechiometrico si ha:
vd = kd [A]a[B]b per la reazione diretta
vi = ki [C]c[D]d per la reazione inversa
all’equilibrio si ha vd = vi
quindi si verifica che kd [A]a[B]b = ki [C]c[D]d da cui:
kd/ ki = [C]c[D]d /[A]a[B]b
poiché il rapporto kd/ki a una data temperatura assume un valore costante che può essere indicato con Kc si ha:
Kc = [C]c[D]d /[A]a[B]b
Tale espressione costituisce un’importante legge chimica nota come legge di azione di massa o legge dell’equilibrio chimico dovuta agli scienziati Guldberg e Waage. Essa afferma che:
A una data temperatura costante il rapporto tra il prodotto della concentrazioni molari dei prodotti di reazione elevate ai rispettivi coefficienti stechiometrici e il prodotto delle concentrazioni molari dei reagenti, elevate anch’esse al proprio coefficiente stechiometrico è costante.
Se il valore della costante Kc è minore di 1 il che implica un basso valore del numeratore rispetto al denominatore all’equilibrio la concentrazione di almeno uno dei prodotti è piccola. Se il valore della costante di equilibrio è maggiore di 1, invece, essendo il numeratore maggiore del denominatore la concentrazione di almeno uno dei due reagenti è piccola e la reazione diretta avviene in modo quasi completo.
Unità di misura della costante
A seconda della reazione l’unità di misura della costante di equilibrio varia. Consideriamo, ad esempio la reazione del biossido di azoto:
2 NO2 ⇄ N2O4
La costante di equilibrio per questa reazione è data da:
Kc = [ N2O4 ] / [NO2]2
Poiché le specie sono espresse in molarità si ha che dimensionalmente la costante vale [mol/L] / [mol/L]2 da cui semplificando si ha 1 / [mol/L] ovvero L mol-1
Per la reazione di equilibrio del pentacloruro di fosforo che dà tricloruro di fosforo e cloro
PCl5 ⇄ PCl3 + Cl2
la costante Kc è data da:
Kc = [PCl3][ Cl2]/[PCl5] e quindi dimensionalmente vale: [mol/L][mol/L]/ [mol/L] = mol L-1
Per la reazione H2 + I2 ⇄ 2 HI
la costante Kc è data da:
Kc = [HI]2/ [H2][I2] e quindi dimensionalmente vale [mol/L]2/ [mol/L][mol/L]/ ovvero è un numero puro.
Generalizzando la costante di equilibrio si esprime in [mol/L] Δn dove Δn è la differenza tra le moli totali dei prodotti e quelle dei reagenti.