I colloidi liofobi sono caratterizzati da scarsa affinità tra la fase dispersa e quella disperdente e sono sistemi instabili che tendono spontaneamente a risolversi, in un tempo più o meno lungo nelle due fasi che li costituiscono. Per questo motivo tutti i sistemi contenenti colloidi liofobi sono eterogenei stante l’esistenza di una superficie di separazione ben netta tra le particelle disperse e il mezzo disperdente.
Premesso che devono essere considerati colloidi tutti quei sistemi formati da particelle aventi diametro compreso tra 10 Ǻ e 10000 Ǻ che si trovano disperse in un mezzo disperdente, sono normalmente compresi nei sistemi colloidali anche quelli costituiti da particelle con diametro maggiore di 10000 Ǻ. Queste se sono solide disperse in un liquido costituiscono le sospensioni, mentre se sono liquide disperse in un liquido costituiscono le emulsioni. Le sospensioni e le emulsioni hanno un comportamento molto simile a quello dei sistemi colloidali. I sistemi colloidali, costituiti da due fasi, una dispersa e l’altra disperdente, sono classificati in colloidi liofobi (idrofobi se il mezzo disperdente è l’acqua) e colloidi liofili (idrofili se il mezzo disperdente è l’acqua).
Classificazione
In dipendenza dello stato fisico della fase dispersa e di quella disperdente, i colloidi liofobi vengono classificati come segue:
|
Classificazione dei colloidi liofobi |
|||
|
Nome |
Fase dispersa |
Fase disperdente |
Esempio |
|
Sol |
Solido |
Liquido |
Au o Ag in acqua |
|
Aerosol |
Solido |
Gas |
Fumo |
|
Aerosol |
Liquido |
Gas |
Nebbia , nuvole |
|
Emulsione |
Liquido |
Liquido |
Latte, maionese |
|
Schiuma |
Gas |
Liquido |
Panna montata |
Il sistema colloidale più studiato è il sol che sono sistemi colloidali di natura organica e che possono essere preparati in vari modi, come ad esempio disperdendo in un mezzo generalmente acquoso, del materiale finemente polverizzato mediante macinazione meccanica. I sol si possono ottenere anche per riscaldamento della soluzione acquosa di alcuni elettroliti.
Esempi
Per esempio l’idrossido di ferro (III) colloidale si forma per ebollizione prolungata di una soluzione acquosa di cloruro di ferro (III). Infatti , per idrolisi totale di questo sale si formano appunto l’idrossido di ferro (III) e l’acido cloridrico volatile secondo la reazione:
FeCl3 + 3 H2O ⇄ Fe(OH)3 + 3 HCl
La stabilità di un sol può protrarsi anche per un tempo assai lungo ed essa può essere imputabile principalmente ad un fattore di natura elettrica.
Infatti, poiché sotto l’azione di un campo elettrico, le particelle dei sol migrano tutte o verso il polo positivo o verso il polo negativo, esse devono possedere una carica elettrica che può essere, per un dato sol, per tutte o positiva o negativa.
A causa della carica elettrica di ugual segno presente su ciascuna delle particelle disperse in un dato colloide, esse tendono a respingersi reciprocamente per repulsione elettrostatica, e pertanto non possono aggregarsi e quindi separarsi dal mezzo disperdente. La carica elettrica presente sulle particelle di un sol è dovuta all’adsorbimento sulla loro superficie di ioni Fe3+ presenti in eccesso nel mezzo disperdente, oppure per adsorbimento sulla loro superficie degli ioni Fe(OH)2+ provenienti dalla dissociazione parziale dell’idrossido:
Fe(OH)3 ⇄ Fe(OH)2+ + OH–
Accade poi che gli ioni isolati presenti nel mezzo disperdente e con carica elettrica opposta a quella della particella colloidale, per attrazione elettrostatica si addensano intorno ad essa neutralizzandone la carica.
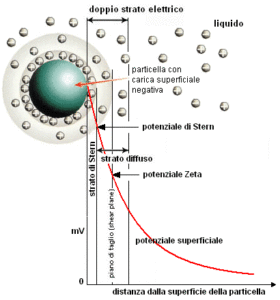
Strato di Stern
Lo strato di liquido che circonda la particella è costituito da due zone: una interna, detta strato di Stern, dove gli ioni sono fortemente legati ed una esterna, detta strato diffuso, dove le interazioni sono più deboli. Le due zone costituiscono un doppio strato elettrico intorno a ciascuna particella.
All’interno dello strato diffuso è possibile individuare un confine teorico entro il quale ioni e particelle formano entità stabili: quando la particella si muove gli ioni all’interno di questo confine si muovono con essa, mentre quelli al di fuori non viaggiano con la particella. Tale confine è detto slipping plane. Il potenziale di tale confine è conosciuto con il nome di potenziale zeta.
 Le particelle colloidali e il doppio strato elettrico ad esse associato sono rappresentati con simboleggiature analoghe a quelle sotto indicate e relative a quelle dei due sol già menzionati:
Le particelle colloidali e il doppio strato elettrico ad esse associato sono rappresentati con simboleggiature analoghe a quelle sotto indicate e relative a quelle dei due sol già menzionati:
[Fe(OH)3]Fe3+⋮ 3 Cl–
[Fe(OH)3]Fe(OH)2+ ⋮ OH–
Dove il simbolo ⋮ indica il limite del doppio strato elettrico.
Poiché lo ioduro di argento, come peraltro molti colloidi liofobi, può formare un sol negativo per adsorbimento sulle sue particelle di ioni I– contenuti in eccesso nella fase disperdente:
[AgI]I– ⋮K+
Oppure un sol positivo [AgI]Ag+- ⋮I–
Questo fatto ha portato a concludere che uno stesso sol può essere dotato di carica positiva o negativa, in dipendenza degli ioni in eccesso contenuti nella fase disperdente.
L’aggiunta di elettroliti, ovvero di ioni positivi e negativi ad un sol, altera l’equilibrio delle cariche del doppio strato elettrico e ciò provoca una rapida aggregazione delle particelle disperse del colloide che si separano subito dal mezzo disperdente sotto forma di fiocchi più o meno compatti.
Flocculazione
Questo fenomeno prende il nome di flocculazione o di gelificazione se il colloide sedimenta allo stato gelatinoso. La minima quantità di elettrolita è necessaria per provocare la flocculazione di un dato sol è indicata come valore di flocculazione. Esso dipende soprattutto dalla natura dell’elettrolita e della carica delle particelle colloidali. In genere il valore di flocculazione di un catione aumenta con il diminuire della sua carica.
Un sol flocculato mediante l’aggiunta di un elettrolita è reversibile. Le particelle raggrumate, possono infatti essere nuovamente disperse nel mezzo disperdente per semplice eliminazione dell’elettrolita flocculante. Un tale processo prende il nome di peptizzazione.
La precipitazione di un sol può essere favorita dalla presenza nel mezzo disperdente di particelle estranee ( impurezze, pulviscolo atmosferico ecc.) che agiscono come centri estranei di aggregazione delle particelle disperse. A differenza di un elettrolita l’aggiunta di un colloide liofilo ad un sol, può migliorarne di molto la stabilità in quanto le particelle disperse vengono protette da un velo di colloide liofilo che ne impedisce l’aggregazione. L’azione stabilizzante di questi colloidi, detti colloidi protettori, è misurata dal numero d’oro. Esso è il numero di milligrammi di sostanza secca del colloide protettore, necessari per impedire il viraggio dal rosso all’azzurro di 10 mL di un sol standard di oro colloidale quando essi vengono addizionati con 1 mL di soluzione al 10% di cloruro di sodio
