Cianuro di sodio: sintesi, reazioni, usi
Il cianuro di sodio è un composto inorganico igroscopico di colore bianco e dal leggero odore di mandorle quando è umido.
Ha formula NaCN ed è un solido ionico che si dissocia in acqua in ioni Na+ e ioni cianuro CN– in cui il carbonio ibridato sp è legato all’azoto tramite un triplo legame.
In acqua dà luogo a un’idrolisi basica infatti il cianuro di sodio deriva dall’acido debole HCN che ha una costante acida dell’ordine di 10-10 pertanto la costante basica relativa all’idrolisi dello ione cianuro è dell’ordine di 10-4.
Ha una struttura cristallina simile a quella del cloruro di sodio la cui solubilità in acqua è influenzata dalla temperatura: a 10°C ha una solubilità di 48 g/100 mL mentre a 34.7 °C ha una solubilità di 82 g/100 mL.
Sintesi del cianuro di sodio
Il cianuro di sodio può essere ottenuto secondo diverse reazioni:
- Secondo il processo Castner-Kellner dalla reazione condotta a 600°C tra sodioammide e carbonio:
NaNH2 + C → HCN + H2
- Dalla reazione tra calciocianammide e carbonato di sodio:
CaCN2 + Na2CO3 →2 HCN + CaCO3
- Dalla reazione tra cianuro di idrogeno e idrossido di sodio:
HCN + NaOH → NaCN + H2O
Reazioni
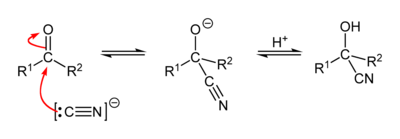
Il cianuro di sodio reagisce con i chetoni per dare cianidrine:
Il cianuro di sodio reagisce con gli alogenuri alchilici primari per dare nitrili
Il cianuro di sodio in presenza di agenti ossidanti dà luogo alla formazione di cianati:
NaCN + 2 KMnO4 + 2 KOH → 2 K2MnO4 + NaCNO + H2O
NaCN + H2O2 → NaCNO + H2O
NaCN + O3 + H2O → NaCNO + O2
Il cianuro di sodio reagisce con acido solforico per dare solfato acido di sodio e il temibilissimo cianuro di idrogeno:
NaCN + H2SO4 → NaHSO4 + HCN
Il cianuro di idrogeno infatti è tristemente noto con il nome di Zyklon B è un pesticida utilizzato come agente tossico nelle camere a gas di alcuni campi di concentramento e sterminio nazisti.
La tossicità dello ione cianuro è dovuta al fatto che esso può dare luogo alla formazione di composti di coordinazione con molti ioni metallici tra cui oro, argento, rame e ferro.
Lo ione cianuro si complessa lo ione ferro presente nel sito attivo dell’enzima citocromo-c ossidasi interrompendo la catena di trasporto degli elettroni con conseguente blocco dell’attività enzimatica che porta alla cessazione della respirazione cellulare e alla morte della cellula.
Usi: estrazione mineraria di oro e argento
Il cianuro di sodio viene usato per l’estrazione mineraria di oro e argento tramite un processo detto processo al cianuro: il minerale finemente suddiviso viene trattato con il cianuro di sodio con ottenimento di un composto di coordinazione solubile.
La reazione per estrarre l’oro è la seguente:
Au(s) + 8 NaCN(s) + O2(g) + 2 H2O(l) → 4 Na[Au(CN)2] (aq) + 4 NaOH(aq)
Mentre quella per l’argento che in genere si trova sotto forma di solfuro è:
Ag2S(s)+ 4 NaCN(s) + H2O(l) → 2 Na[Ag(CN)2] (aq) + NaHS(aq) + NaOH(aq)
La reazione tra oro e cianuro di sodio viene sfruttata nella galvanostegia per ricoprire un metallo non prezioso con un sottile strato di un metallo più prezioso o più nobile o passivabile tramite l’ elettrodeposizione.
La soluzione contenente sodio dicianoaurato (I) dissociato in acqua in Na+ e Ag(CN)2– è sottoposta a elettrolisi. Il polo negativo è costituito dall’oggetto che deve essere ricoperto che costituisce il catodo dove avviene la semireazione di riduzione:
Ag(CN)2–(aq) + 1 e– → Au(s) + 2 CN–(aq)
Al polo positivo ovvero l’anodo, costituito da oro, avviene la semireazione di ossidazione:
Au(s) + 2 CN–(aq)→ Ag(CN)2–(aq) + 1 e–