Titolazione Karl Fischer: applicazioni, reazioni
In chimica analitica la titolazione Karl Fischer è un metodo universalmente riconosciuto per la misura del contenuto di acqua in tutti i tipi di sostanze, tra cui oli, prodotti farmaceutici e alimentari.
La determinazione del contenuto di acqua riveste infatti una particolare importanza in quanto la sua presenza influenza le prestazioni di una sostanza.
Ad esempio la benzina, le proprietà organolettiche e la stabilità di sostanze quali farmaci e alimenti conservati.
Tale tecnica analitica è rapida, non comporta reazioni collaterali ed è di semplice attuazione.
Non richiede tecniche strumentali quali la :
- spettroscopia infrarossa
- gascromatografia
- spettroscopia a microonde.
Applicazioni della titolazione Karl Fischer
La titolazione Karl Fischer fu divulgata nel 1935 è usata nell’industria;
1) alimentare per la determinazione del tenore di acqua nel miele, zuccheri e derivati, oli e grassi, cereali, pane, pasta, prodotti caseari e petrolchimica.
2) farmaceutica per la determinazione del tenore di acqua nei farmaci
3) cosmetica per la determinazione del tenore di acqua nelle creme, nel dentifricio ecc.
4) chimica per la determinazione del tenore di acqua nei composti organici, solventi, vernici, lacche, adesivi, carta ecc.
5) petrolchimica per la determinazione del tenore di acqua negli oli, lubrificanti, grassi, oli minerali, idrocarburi
Fino ad allora era usata un’altra tecnica che si basava sulla misurazione del contenuto in acqua per essiccamento del campione in stufa; quest’ultima, tuttavia presenta alcuni svantaggi in quanto è particolarmente lunga dovendo, il campione in esame rimanere in stufa fino a costanza di peso e ciò impone tempi lunghi. Inoltre se nel campione sono presenti composti volatili anche essi sono allontanati dal campione insieme all’acqua determinando un errore nella determinazione. Pertanto l’essiccamento in stufa non costituisce un metodo selettivo.
Reazioni nella titolazione Karl Fischer
La titolazione Karl Fischer si basa sulla reazione di Bunsen in cui avviene l’ossidazione del il biossido di zolfo da parte dello iodio:
I2+ SO2 + 2H2O → 2 HI+ H2SO4
La titolazione viene condotta in un solvente anidro come, ad esempio, il metanolo e in presenza di una base come la piridina, sostituita successivamente dall’imidazolo per la sua minore tossicità, al fine di neutralizzare l’acido solforico che si produce dalla reazione formando una soluzione tampone con valori di pH compresi tra 5 e 7.
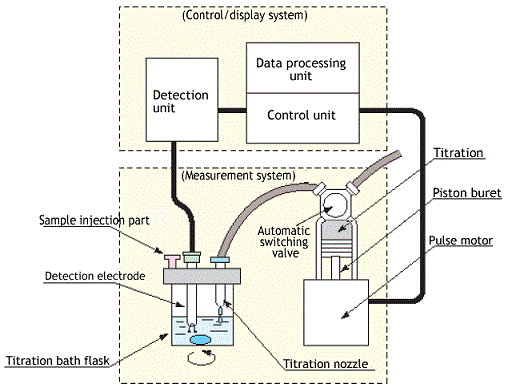
Il titolatore di Karl Fischer utilizza la titolazione coulometrica, che è la più idonea determinare bassissimi contenuti di acqua, permettendo dosaggi di 10 ug. di H2O fino ad un massimo del 5% (limite massimo consigliato) rispetto alla titolazione volumetrica.
Nella reazione di Karl Fischer, l’acqua reagisce con lo iodio e l’anidride solforosa in presenza della base RN e di alcol.
H2O + I2 + SO2 + CH3OH + 3 RN → (RNH)SO4CH3 + 2(RNH)I (1)
Nella titolazione volumetrica lo iodio è aggiunto come soluzione titolante mentre nella tecnica coulometrica lo iodio è generato elettroliticamente
2 I– → I2 + 2 e–
Fino a quando l’acqua sarà presente nella cella di reazione lo iodio generato reagirà secondo la reazione (1).
Quando tutta l’acqua avrà reagito si formerà un eccesso di iodio rilevato da un doppio elettrodo di platino nell’analita ovvero nella porzione della soluzione elettrolitica che si trova in prossimità dell’anodo e nella quale si verificano reazioni di ossidazione anodica . In accordo con le leggi di Farady, la quantità di iodio prodotta sarà proporzionale alla corrente generata.
Nella equazione (1) lo iodio e l’acqua reagiscono in rapporto di 1:1 pertanto una mole di acqua (18 g) è equivalente a 2 ∙ 96.500 coulombs.
La quantità totale di acqua contenuta nel campione potrà così essere determinata misurando il consumo totale di elettricità.
La cella di titolazione deve essere protetta dall’umidità atmosferica e il campione non deve reagire con il reagente KF. Ad esempio, chetoni e aldeidi devono essere titolati in solventi privi di metanolo perché altrimenti reagiscono con il metanolo formando acqua, il che si traduce in una concentrazione di acqua falsamente elevata e un punto finale nullo.



