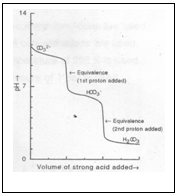
Titolazione del carbonato di sodio con HCl
La titolazione del carbonato di sodio con acido cloridrico è una titolazione di una base debole diprotica con un acido forte e viene effettuata per determinare la quantità del sale presente in una soluzione.
Il carbonato di sodio è un sale completamente dissociato secondo la reazione:
Na2CO3 → 2 Na+ + CO32-
Lo ione sodio derivante dalla base forte non idrolizza mentre lo ione carbonato reagisce con lo ione H+ secondo l’equilibrio:
CO32- + H+ ⇄ HCO3– (1)
Lo ione bicarbonato reagisce con H+ secondo l’equilibrio:
HCO3– + H+ ⇄ H2CO3 (2)
Le espressioni relative alla dissociazione dell’acido carbonico e del bicarbonato sono rispettivamente:
Ka1 = [H+][ HCO3–]/[ H2CO3] = 3.5 ∙ 10-7
Ka2 = [H+][ CO32-]/[ HCO3–] = 5.0 ∙ 10-11
Essendo Ka1 e Ka2 le costanti di prima e seconda dissociazione dell’acido carbonico.
Inizio titolazione
All’inizio della titolazione, ovvero quando il volume di titolante aggiunto è pari a zero il pH della soluzione di carbonato di sodio che si supponga avere concentrazione 0.100 M può essere calcolato come segue:
si consideri la reazione di idrolisi del carbonato:
CO32- + H2O ⇄ HCO3– + OH– (3)
L’espressione della costante di idrolisi è:
Kh = [HCO3–][ OH–] / [CO32-]
Moltiplicando numeratore e denominatore per [H+] si ha:
Kh = [HCO3–][ OH–][H+] / [CO32-][H+]
Essendo Kw = [ OH–][H+] = 1.00 ∙ 10-14 a 25°C si ha:
Kh = [HCO3–]Kw / [CO32-][ H+]
In definitiva Kh più frequentemente indicata come Kb è data da:
Kh = Kb = Kw/ Ka2= 1.00 ∙ 10-14/ 5.0 ∙ 10-11 = 2.0 ∙ 10-4
All’equilibrio: [HCO3–] = [OH– ] e [CO32-]= 0.100-x
Si può assumere che [CO32-] ≅ 0.100
Pertanto: Kh = [HCO3–][ OH–] / [CO32-] = 2.0 ∙ 10-4 = [OH–]2/ 0.100
Da cui [OH–]2 = 2.0 ∙ 10-5 e [OH–] = √2.0 ∙ 10-5 = 0.0045 M
Conseguentemente pOH = – log 0.0045 = 2.3 e quindi pH = 14 – pOH = 14 – 2.3 = 11.7
Si supponga che il volume della soluzione di carbonato di sodio sia pari a 50.0 mL; le moli di carbonato sono pari a 0.0500 L ∙ 0.100 M = 0.00500.
Metà del primo punto equivalente
Dopo l’aggiunta di 0.00500/2 = 0.00250 moli di HCl ci si trova a metà del primo punto equivalente ( half-equivalence point): si verifica la reazione CO32- + H+ ⇄ HCO3–
A questo punto la metà del carbonato si è trasformata in carbonato acido ovvero [HCO3– ] = [CO32-]. Prendiamo in considerazione l’espressione Ka2 = [H+][ CO32-]/[ HCO3–] = 5.0 ∙ 10-11
Da cui: [H+] = Ka2 [ HCO3–]/ [CO32-]
Poiché [HCO3– ] = [CO32-] si ha:
[H+] = Ka2 = 5.0 ∙ 10-11
Da cui pH = – log 5.0 ∙ 10-11 = 10.3
Primo punto equivalente
Dopo l’aggiunta di 0.00500 moli di HCl si è raggiunto il primo punto equivalente e tutto il carbonato si è trasformato in carbonato acido: pH = ½ ( pKa1+ pKa2) = 8.4
Dopo l’aggiunta di 0.00750 moli di HCl metà del bicarbonato si è trasformata in acido carbonico e, con ragionamento del tutto analogo a quello fatto per la metà del primo punto equivalente si ha: [H+] = Ka1 = 3.5 ∙ 10-7 da cui pH = 6.5
Secondo punto equivalente
Dopo l’aggiunta di 0.100 moli di HCl tutto il bicarbonato si è trasformato in acido carbonico e [H+] = √Ka1C e per una titolazione di carbonato di sodio 0.100 M con HCl 0.100 M il valore del pH = 3.8
Nella pratica, l’individuazione dei due punti equivalenti viene rilevata con l’utilizzo di due indicatori:
la soluzione a volume noto di carbonato di sodio viene messa nella beuta e l’acido cloridrico standardizzato nella buretta. Alla soluzione vengono aggiunte 3-4 gocce di fenolftaleina e si titola vino al viraggio dell’indicatore a incolore. Si legge il volume di titolante occorso (corrispondente al primo punto equivalente) , indi si aggiungono 4-5 gocce di metilarancio e si titola fino al viraggio del secondo indicatore a rosso ( corrispondente al secondo punto equivalente) . Il volume di titolante viene così letto nuovamente.
Riportando in grafico il pH in funzione del volume di titolante aggiunto si ottiene la seguente curva di titolazione: