Determinazione del rame in un minerale: iodometria, reagenti e soluzioni standard
La determinazione del rame contenuto in un minerale può essere fatta tramite una titolazione indiretta detta iodometrica.
In soluzione acida tutti gli agenti ossidanti sono in grado di ossidare in modo quantitativo lo ioduro a iodio; quest’ultimo può essere titolato con una soluzione standardizzata di tiosolfato di sodio.
Iodometria
La iodometria utilizza le proprietà ossidanti dello iodio e ha il vantaggio di non essere limitata a determinati valori di pH. Il test iodio-amido fu descritto per la prima volta nel 1814 da Jean-Jacques Colin e Henri-François Gaultier de Claubry e, indipendentemente da Friedrich Stromeyer, nello stesso anno.
I metodi iodometrici sono impiegati per le seguenti motivazioni:
1) Lo ioduro di potassio KI è disponibile ad alta purezza
2) L’indicatore usato nella titolazione, la salda d’amido, è molto sensibile nell’individuazione del punto equivalente nella reazione tra iodio e tiosolfato
3) Le reazioni sono rapide e quantitative
4) Il tiosolfato di sodio è una sostanza stabile
I metodi iodometrici trovano applicazione nella determinazione di forti agenti ossidanti quali il permanganato di potassio, bicromato di potassio,perossido di idrogeno e lo ione Cu2+.
Si può pertanto determinare la quantità di rame presente in un minerale, prevalentemente presente come CuO, seguendo questa metodologia.
Un campione di minerale viene sciolto a caldo in acido nitrico che ossida il rame a Cu2+. Alla soluzione contenente lo ione viene ioduro di potassio che riduce lo ione Cu2+ a Cu+ sotto forma del sale poco solubile CuI dando ioni I3– secondo la reazione:
2 Cu2+ + 5 I– → 2 CuI(s) + I3–
Lo ione I3– viene quindi titolato con una soluzione di tiosolfato di sodio Na2S2O3 e dalla reazione si ottiene ioduro I– e tetrationato S4O62-:
I3– + 2 S2O32- → 3 I– + S4O62-
Il punto finale della titolazione viene evidenziato dalla variazione di colore della salda d’amido.
La determinazione del rame presente nel minerale è ottenuta considerando la stechiometria complessiva delle due reazioni: moli di rame = moli di tiosolfato.
Reagenti e soluzioni standard
Preparazione della soluzione 0.10 M di titosolfato di sodio
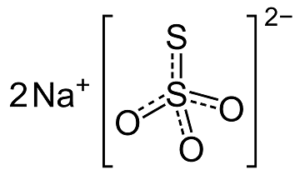
Far bollire per circa 10.15 minuti 500 mL di acqua distillata onde distruggere eventuali microrganismi che possono metabolizzare lo ione tiosolfato. Dopo che l’acqua si è raffreddata aggiungere 12.5 g di tiosolfato di sodio pentaidrato e circa 0.05 g di carbonato di sodio. L’aggiunta di Na2CO3 è dovuta al fatto che si deve ottenere un valore di pH pari a circa a 9. Dopo aver agitato per consentire la completa dissoluzione dei sali, conservare la soluzione in un luogo buio.
Preparazione della soluzione 0.01 M di KIO3
Mettere in stufa per circa un’ora a 110 °C una quantità di KIO3 di circa 1.2 g. Pesare circa 1.1 g (± 0.1 mg) di iodato di potassio e trasferirlo quantitativamente in un matraccio da 500 mL e portare a volume
Preparazione della soluzione di salda d’amido
Le soluzioni di salda d’amido devono essere preparate di fresco. Sciogliere circa 2 g di amido solubile per ogni 100 mL di acqua. Lasciar sobbollire la soluzione, se necessario, fin quando diventa limpida.
Standardizzazione della soluzione 0.10 M di tiosolfato di sodio
Prelevare 50.00 mL di soluzione di KIO3 , aggiungere circa 2 g di KI e dopo che è avvenuta la dissoluzione aggiungere circa 2 mL di HCl 6 M e titolare con la soluzione di tiosolfato fino a che la soluzione diventa giallo pallido. Aggiungere 2 mL di salda d’amido e continuare la titolazione fin quando la colorazione blu impartita dall’indicatore alla soluzione tende a scomparire. Ripetere la titolazione almeno 3 volte.
Determinazione del rame
1) Mettere circa 3.5 g di minerale in stufa per un’ora a 110°C. Pesare 1 g (± 0.1 mg) di minerale e metterlo in un beaker da 250 mL.
2) Aggiungere 5 mL di HNO3 concentrato e riscaldare senza raggiungere l’ebollizione per sciogliere il minerale. Far raffreddare a aggiungere 10 mL di H2SO4 concentrato fin quando si sviluppa il gas di colore giallo SO3 quindi raffreddare. Aggiungere 30 mL di acqua distillata e portare all’ebollizione per 1-2 minuti poi lasciar raffreddare. Aggiungere ammoniaca concentrata goccia a goccia fin quando compare la colorazione blu del complesso Cu(NH3)2+. Aggiungere acido solforico 3 M fin quando scompare la colorazione blu ed infine aggiungere 2 mL di H3PO4 all’85% e lasciar raffreddare a temperatura ambiente.
3) Aggiungere circa 4 g di KI al fine di precipitare il rame come CuI e titolare con la soluzione standardizzata di Na2S2O3. tiosolfato fino a che la soluzione diventa giallo pallido. Aggiungere 2 mL di salda d’amido e continuare la titolazione fin quando la colorazione blu impartita dall’indicatore alla soluzione tende a scomparire. Aggiungere circa 2 g di KSCN, agitare e continuare la titolazione fin quando la colorazione blu scompare. L’aggiunta di KSCN onde evitare che I2 e I3– siano adsorbiti sulla superficie di CuI.
4) Dopo aver ripetuto tre titolazioni determinare la quantità di rame presente nel minerale



