Glicosidi cianogenici
I glicosidi cianogenici (CNglcs) derivano da L-amminoacidi e sono metaboliti secondari contenenti azoto che hanno la capacità di produrre acido cianidrico quando degradati dagli enzimi vegetali. Si presume che si siano evoluti principalmente come deterrente per gli erbivori svolgendo svolgono un ruolo fondamentale nell’organizzazione del sistema di difesa chimica nelle piante e nelle interazioni pianta-insetto.
Tuttavia alcuni lavori recenti indicano che i glicosidi cianogenici possono anche svolgere molti altri ruoli importanti, tra cui lo stoccaggio di azoto e carbonio e il trasporto nei tessuti vegetali, la modulazione dello stress ossidativo e regolazione della germinazione dei semi.
I glicosidi cianogenici sono presenti in almeno 2000 specie vegetali, e sono comuni in alcune famiglie come Fabaceae, Rosaceae, Linaceae e Asteracee e, nonostante la loro grande diversità strutturale, si ritiene che quasi tutti derivino da soli sei diversi aminoacidi L-valina, L-isoleucina, L-leucina, L-fenilalanina e L-tirosina.
Struttura dei glicosidi cianogenici
Sono costituiti da una parte zuccherina e da una porzione non zuccherina, detta aglicone. I glicosidi cianogeni naturali mostrano variazioni sia per quanto riguarda la parte aglicone che quella zuccherina delle molecole. La porzione predominante dello zucchero è il glucosio mentre l’aglicone può essere alifatico, ciclico, aromatico ed eterociclico.
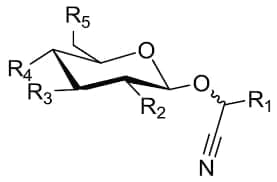
Sono degli α-idrossinitrili con una struttura generale rappresentata in figura in cui R1 rappresenta la parte aglicone mentre R2, R3, R4 e R5 rappresentano le possibili posizioni dei sostituenti attaccati alla porzione dello zucchero, generalmente glucosio o da una frazione di glucosio sostituita.
Oltre al glucosio, i seguenti zuccheri sono stati segnalati come parti dei glicosidi cianogeni: allosio, arabinosio, ramnosio e xilosio. Alcuni glicosidi cianogenici naturali sono enantiomeri, e differiscono nella stereochimica dell’aglicone, ma non della parte zuccherina. La parte aglicone è costituita da un gruppo nitrilico legato a una porzione alifatica, ciclica, aromatica o eterociclica
Biosintesi
I glicosidi cianogenici sono biosintetizzati a partire da L-amminoacidi proteici i quali, a seguito di idrolisi danno luogo alla formazione di N-idrossi amminoacidi. Questi ultimi formano aldossime per decarbossilazione ossidativa.
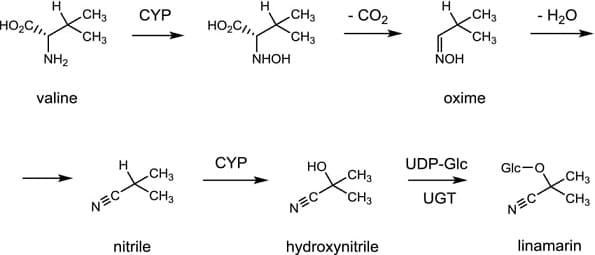
L’aldossima deidratasi, enzima contenente un gruppo eme, appartenente alla famiglia delle liasi, catalizza la disidratazione degli aldossime nel corrispondente nitrile. Il nitrile è quindi idrossilato sul carbonio in posizione 2 per azione dell’enzima nitrile monoossigenasi per dare l’intermedio chiave ovvero il 2-idrossinitrile (cianidrina).
Per azione delle glucosiltransferasi, tipo di glicosiltransferasi, che catalizzano il trasferimento di glucosio utilizzando l’UDP-glucosio si formano i glicosidi cianogeni.L’UTP-glucosio costituisce una forma attivata del glucosio analogamente a come l’ATP e l’acetil CoA sono rispettivamente forme attivate rispettivamente dell’ortofosfato e dell’acetato.
Principali glicosidi cianogenici
Alcuni esempi di glicosidi cianogenici sono la linamarina presente nella manioca, nel trifoglio bianco e nei semi di lino, il dhurrin presente nel genere Sorghum, la prunasina e l’amigdalina prodotta principalmente da piante rosacee come mela, pera e ciliegia che fu il primo glicoside cianogenico isolato.

La linamarina rappresenta oltre l’80% dei glucosidi cianogenici della manioca che svolge molteplici funzioni nella fisiologia vegetale, agendo come trasportatore di azoto dalle foglie alle radici nelle piante giovani e funzionando anche come meccanismo di difesa.
La prunasina è il glucoside dell’ (R)-mandelonitrile e produce benzaldeide per idrolisi, che spiega il caratteristico aroma di mandorla della corteccia di ciliegio selvatico. La prunasina viene convertita in amigdalina dall’enzima UDP-glucosiltransferasi o degradata in benzaldeide e acido cianidrico.
L’amigdalina deriva dall’amminoacido aromatico fenilalanina ed è contenuta in particolare nei noccioli di albicocche, mandorle amare, mele, pesche, ciliegie e prugne e nelle radici di manioca. Essa è composta da due molecole di glucosio, benzaldeide e un gruppo nitrile e può esistere sotto forma di due epimeri R e S sebbene la forma R sia quella presente in natura.
Glicosidi cianogenici e alimenti
I glicosidi cianogenici si trovano generalmente nelle parti commestibili delle piante e in alcuni ingredienti alimentari come polvere o pasta di mandorle tritate, marzapane, drupacee e bevande alcoliche a base di drupacee che rappresentano quindi potenziali fonti di acido cianidrico.
La tossicità dei glicosidi cianogenici è associata alla loro capacità di essere idrolizzati spontaneamente o in presenza di enzimi per produrre cianuro, implicato nell’avvelenamento acuto da cianuro e tra le principali cause di numerose malattie croniche, come prodotti finali della loro idrolisi. La tossicità da cianuro può verificarsi negli animali, compreso l’uomo, a dosi comprese tra 0.5 e 3.5 mg di HCN per chilogrammo di peso corporeo.
Al di sopra di un certo livello, il cianuro inibisce il citocromo c ossidasi, enzima terminale della catena di trasporto degli elettroni nel mitocondrio, in quanto si lega in modo competitivo al cofattore di riduzione dell’ossigeno della proteina.
Questo effetto provoca un ridotto utilizzo di ossigeno e un aumento del metabolismo anaerobico, portando ad un eccesso di acido lattico e ad acidosi metabolica e infine alla morte cellulare per privazione di energia. A causa della sua elevata dipendenza dal metabolismo ossidativo, il sistema nervoso centrale è particolarmente vulnerabile all’intossicazione da cianuro.



