Il diagramma di fase di sistemi ad un componente consente di determinare i campi di esistenza delle diverse fasi e le condizioni di equilibrio tra loro
Riportando in un piano pressione e temperatura le relazioni relative agli equilibri:
– Sublimazione solido-vapore Esempio: CO2 solida- CO2 gassosa
– Evaporazione: equilibrio liquido-vapore Esempio: acqua-vapore
– Fusione o equilibrio solido-liquido Esempio: ghiaccio-acqua
– Allotropia o equilibrio tra fasi cristalline differenti Esempio: zolfo rombico-zolfo monoclino
si ottiene il diagramma di fase o diagramma di stato della sostanza. Le linee che in un diagramma di stato separano due regioni sono dette confini di fase. I punti che si trovano su tali linee corrispondono a condizioni termodinamiche in cui si trovano in equilibrio dinamico due stati fisici.
Diagramma di stato dell’acqua
In figura è riportato il diagramma di fase dell’acqua costruito da dati sperimentali pressione-temperatura nei tre stati di aggregazione della sostanza:
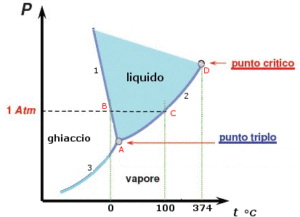 La curva 1 evidenzia le condizioni di pressione e temperatura in corrispondenza delle quali il solido si trova in punto equilibrio con il liquido. La curva mostra la variazione della temperatura di fusione del ghiaccio al variare della pressione. Va evidenziato che nelle maggior parte delle sostanze esibiscono una pendenza positiva della curva. Nel caso dell’acqua si ha una pendenza negativa. Ciò implica che all’aumentare della pressione la temperatura di fusione dell’acqua si abbassa. Infatti l’acqua , al contrario della gran parte delle altre sostanze liquide, quando congela aumenta di volume.
La curva 1 evidenzia le condizioni di pressione e temperatura in corrispondenza delle quali il solido si trova in punto equilibrio con il liquido. La curva mostra la variazione della temperatura di fusione del ghiaccio al variare della pressione. Va evidenziato che nelle maggior parte delle sostanze esibiscono una pendenza positiva della curva. Nel caso dell’acqua si ha una pendenza negativa. Ciò implica che all’aumentare della pressione la temperatura di fusione dell’acqua si abbassa. Infatti l’acqua , al contrario della gran parte delle altre sostanze liquide, quando congela aumenta di volume.
La curva 2 mostra le condizioni di pressione e temperatura in corrispondenza delle quali il liquido si trova in equilibrio con il proprio vapore.
La curva 3 mostra le condizioni di pressione e di temperatura in corrispondenza delle quali il solido si trova in equilibrio con il proprio vapore.
Il punto A prende il nome di punto triplo in quanto coesistono la fase solida, la fase liquida e la fase gassosa in equilibrio dinamico. Il punto triplo è caratterizzato da un unico valore di temperatura e pressione che per l’acqua sono rispettivamente 0.01 °C e 4.58 mm Hg. In tale punto la tensione di vapore del solido è uguale alla tensione di vapore del liquido. Poiché il punto triplo è il punto più basso della regione in cui una sostanza esiste allo stato liquido, esso segna la pressione al di sotto della quale uno sostanza non può esistere allo stato liquido, qualunque sia la sua temperatura. Così se in una fredda e asciutta mattinata d’inverno la pressione parziale di vapore è inferiore a 4,6 mm di Hg e la temperatura scende sotto 0,01°C il vapore può trasformarsi direttamente in ghiaccio (brina) senza passare allo stato liquido.
Il punto:
- B rappresenta il normale punto di fusione del ghiaccio
- C rappresenta il normale punto di ebollizione dell’acqua essendo l’intersezione della curva 1 e 2 con l’ordinata di 1 atmosfera.
- D è il punto critico dell’acqua ( 374 °C e 218 atm) oltre il quale non può esistere l’equilibrio liquido-vapore, in quanto oltre la pressione critica l’acqua esiste solo allo stato gassoso.
Equazione di Clausius-Clapeyron
L’andamento esponenziale della curva 2 e della curva 3 è regolato dall’equazione di Clausius-Clapeyron:
dP/dT = Pλ/RT2
La loro diversa pendenza può essere spiegata qualitativamente prolungando la curva 2 oltre il punto triplo e, tenendo conto che a parità di temperatura, la pressione di vapore di un liquido è maggiore di quella di una sostanza allo stato solido. Infatti, la libertà di movimento e quindi la facilità di evaporazione delle particelle di una sostanza in fase liquida è maggiore di quella della particelle di una sostanza in fase solida. L’andamento della curva 1, dalla quale risulta che il punto di fusione del ghiaccio diminuisce con l’aumentare della pressione esterna, è regolato dall’equazione di Clapeyron:
dp/dT = λ/ TΔV
In questo caso ΔV (ΔV= Vliquido– Vsolido) è negativo in quanto la fusione del ghiaccio si verifica con una diminuzione di volume.
Una volta costruito con dati sperimentali il diagramma di fase di una sostanza pura, è possibile prevedere le condizioni sperimentali più favorevoli per l’esistenza di una sola fase di aggregazione della sostanza, oppure affinché due o tutte e tre le fasi di detta sostanza possano coesistere in equilibrio.
Ad esempio, prendendo in esame il diagramma di stato dell’acqua, ogni coppia di valori di pressione e di temperatura arbitrariamente scelta, definisce un punto del diagramma. Se detto punto si trova in una delle tre regioni del diagramma (solido, liquido o vapore) significa che in dette condizioni sperimentali, è stabile la fase di aggregazione della sostanza in cui detto punto è individuato. Se il punto coincide con uno dei punti allineati su una delle tre curve significa che in tale condizione sono presenti rispettivamente le fasi solido-vapore, liquido-vapore, solido-vapore.
Regola delle fasi
I diagrammi di fase possono essere immediatamente interpretati applicando la regola delle fasi:
v = c + 2 – f
Ad esempio nel caso dell’acqua pura, si ha un solo componente indipendente (c=1) e i fattori che regolano l’equilibrio sono due (pressione e temperatura). Al punto triplo essendo presenti tre fasi si ha:
v = 1 + 2 – 3 = 0 ovvero il sistema è zerovariante (o invariante). Questo significa che esiste una sola pressione e una sola temperatura alla quale possono coesistere in equilibrio le tre fasi della sostanza pura. Se applichiamo la regola delle fasi ad un punto qualunque appartenente a una delle tre curve del diagramma, essendo presenti due fasi otteniamo:
v = 1 + 2 -2 = 1 ovvero il sistema è monovariante. Ovvero fissata la temperatura o la pressione esiste un solo valore di pressione o di temperatura in cui possono coesistere contemporaneamente due fasi di aggregazione della sostanza. Se infine applichiamo la regola delle fasi ad qualsiasi altro punto del diagramma essendo presente una sola fase otteniamo:
v = 1 + 2 – 1 = 2 ovvero il sistema è bivariante. Questo significa che possono essere arbitrariamente variate, entro certi limiti, sia la pressione che la temperatura, senza che scompaia l’unica fase della sostanza.
