Trifluoruro di bromo: autoionizzazione, sintesi, reazioni
Il trifluoruro di bromo è un composto interalogeno avente formula BrF3 utilizzato quale agente fluorurante e quale solvente per i fluoruri
Geometria molecolare
Il composto presenta tre legami tra il bromo e il fluoro ovvero tre coppie di elettroni di legame. Il bromo ha due coppie di elettroni di non legame quindi, per la teoria VSEPR ha un totale di cinque coppie di elettroni di cui due di non legame.
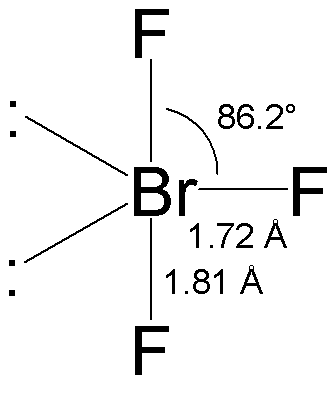
Esso ha quindi una geometria molecolare trigonale bipiramidale a forma di T (T-shaped).Nel composto il bromo è ibridato sp3d e l’angolo di legame è di 86.2° . Pertanto nonostante la differenza di elettronegatività tra bromo e fluoro a causa della distribuzione asimmetrica degli elettroni è una molecola polare.
Proprietà del trifluoruro di bromo
È un liquido incolore dall’odore irritante, altamente dannoso per i tessuti umani e per la pelle.
Ha caratteristiche simili all’acqua per quanto attiene la temperatura di fusione che è di 8.8°C e di ebollizione che è di 127°C.
Analogamente all’acqua dà autoionizzazione secondo la reazione:
2 BrF3 → BrF2+ + BrF4–
La costante di autoionizzazione è pari a 8.0 · 10-3
I prodotti, come quelli dell’autoionizzazione dell’acqua, sono un acido BrF2+ e una base BrF4–.
Proprietà acido-base
Tuttavia, a differenza dell’acqua, BrF3 reagisce con acidi e basi fluorurati, non con acidi e basi protici.
È un solvente protico che agisce da acido con i donatori di ione fluoruro come il fluoruro di potassio:
BrF3 + KF → BrF4– + K+
Esempi dello stesso tipo sono:
BrF3 + AgF → BrF4– + Ag+
BrF3 + NOF → BrF4– + NO+
Il trifluoruro di bromo agisce da base con gli accettori di ioni fluoruro come il pentafluoruro di antimonio:
BrF3 + SbF5 → BrF2+ + SbF6–
Sintesi
Si ottiene:
- per reazione del bromo con il fluoro:
Br2 + 3 F2 → 2 BrF3
- secondo una reazione di disproporzione del fluoruro di bromo:
3 BrF → BrF3 + Br2
Reazioni
Reagisce con ossidi metallici in modo quantitativo per dare ossigeno e bromo:
4 BrF3(l) + 3 TiO2(s) → 3 TiF4(s) + 2 Br2(l) + 3 O2(g)
20 BrF3(l) + 6 V2O5(s) → 12 VF5(s)+ 10 Br2(l) + 15 O2(g)
Dà luogo a una reazione esotermica con l’acqua da cui si ottiene acido fluoridrico, acido bromidrico e ossigeno:
BrF3 + 2 H2O → 3 HF + HBr + O2
Usi
Oltre che come solvente e agente fluorurante è utilizzato per la produzione di esafluoruro di uranio. Poiché è un agente ossidante estremamente reattivo e corrosivo viene utilizzato nella lavorazione del combustibile dei reattori nucleari



