Coenzimi: struttura, meccanismo di azione
I coenzimi sono composti organici di natura non proteica che si legano a un enzima per catalizzare una determinata reazione.
Le catene laterali dei 20 amminoacidi che costituiscono le proteine non forniscono gruppi funzionali sufficientemente vari da catalizzare tutte le reazioni necessarie al metabolismo. Di conseguenza, molti centri attivi degli enzimi richiedono, per poter esercitare la loro azione catalitica, dei gruppi funzionali particolari. Questi gruppi sono forniti all’enzima da piccole molecole dette coenzimi che si legano all’enzima.
Nelle ossidoreduttasi il coenzima è un agente ossidante o riducente che generalmente deve allontanarsi dopo aver esercitato la sua azione per “ricaricarsi” da qualche altra parte, per riconvertirsi cioè nella sua forma ossidante o riducente. Le vitamine sono generalmente dei coenzimi che vengono forniti dal cibo della nostra dieta poiché l’organismo dipende da altri organismi che svolgono la loro sintesi.
Il coenzima principale della ossidoriduttasi è il dinucleotide nicotinammide-adenina ( NAD) identificato da Arthur Harden e William Young nel 1906 che si trasforma nella forma ridotta NADH
L’NAD è quindi un agente ossidante perché è capace di deidrogenare un substrato. Viceversa NADH è un agente riducente che può cedere uno ione idruro, analogamente agli idruri metallici:
lo schema più comune per simboleggiare le reazioni biochimiche è esemplificato dalla riduzione dello ione piruvato con NADH
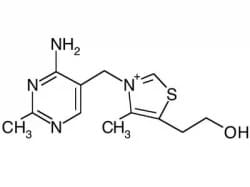
Struttura
La vitamina B1 o tiamina pirofosfato TTP , è un coenzima universale, avente una funzione catalitica ben specifica: questo coenzima è responsabile della decarbossilazione degli α-chetoacidi
Agisce soprattutto della conversione dello ione piruvato nell’importante tioestere dell’acido acetico, l’acetil-coenzima A.
Questo tioestere collega le reazioni relativa alla scissione del glucosio con l’ossidazione finale dell’acido acetico ad anidride carbonica entro il ciclo dell’acido citrico. La chiave dell’azione della tiamina sta nell’acidità del protone come da figura:
La base coniugata della tiamina è stabilizzata elettrostaticamente dall’adiacente N+ da un lato e per risonanza (retrodonazione negli orbitali d dello zolfo adiacente) dall’altro. Per questa ragione la forma anionica della tiamina è presente in quantità sufficiente anche per reagire a pH 7. L’anione attacca il gruppo chetonico molto reattivo degli α- chetoacidi, seguendo una serie di passaggi.
Un altro esempio di azione enzimatica è la versatilità della vitamina B6 detta piridossale.
Questo coenzima agisce nella sintesi e nella degradazione degli amminoacidi. Il gruppo aldeidico reagisce facilmente con un amminoacido per formare un’immina, complessata come chelato con uno ione metallico. La capacità dell’anello piridinico di accettare elettroni gli permette di agire come un carbonile vinilogo in enolizzazioni o in decarbossilazioni o, perfino, in taluni casi, nella scissione del legame C-R.
In ogni caso il prodotto sarà un’immina che per idrolisi forma facilmente o un’aldeide R-CHO o un α- chetoacido R-CO-COOH. La reazione inversa viene utilizzata nella sintesi di amminoacidi partendo da α-chetoacidi, come la conversione di acido piruvico in alanina. Tutte queste reazioni avvengono in vitro utilizzando solo piridossale e ioni metallici; esse sono tuttavia più veloci in presenza dell’enzima appropriato.
Riduzione mediante coenzimi
I coenzimi sono molecole organiche relativamente piccole spesso derivate da vitamine. Alcuni sono reagenti nelle reazioni catalizzate da enzimi mentre altri sono parti essenziali di molti enzimi (a volte chiamati gruppi prostetici). I coenzimi sono spesso importanti negli enzimi che effettuano reazioni di ossidazione o riduzione e possono partecipare come trasportatori di elettroni.
È stato osservato che in alcuni casi il coenzima da solo può catalizzare importanti reazioni biodegradative con composti poco reattivi. Ad esempio, la cianocobalamina e altri derivati simili della vitamina B 12 sono in grado di catalizzare reazioni di declorazione riduttiva. I composti declorurati in questo modo includono, esaclorobenzene , tetracloruro di carbonio , cloroformio, diclorometano ed etani clorurati. Alcuni altri coenzimi che coinvolgono metalli di transizione, ad esempio nichel e ferro, può avere effetti simili. Si ritiene che in alcuni casi i nucleotidi flavinici ridotti (FMN e FAD) mediano la riduzione del colorante azoico .




