Biocatalisi, applicazioni
Nella biocatalisi si utilizzano catalizzatori, spesso di natura enzimatica, per accelerare il decorso di una reazione abbassandone l’energia di attivazione. Di conseguenza, i prodotti delle reazioni si formano più velocemente e le reazioni raggiungono il loro stato di equilibrio più rapidamente.
La biocatalisi si avvale quindi di biocatalizzatori, detti anche catalizzatori intelligenti che, rispetto a quelli tradizionali, offrono elevata specificità, condizioni di reazione più blande e velocità di reazione più rapide.
Grazie al risultato dei progressi della biologia molecolare e della biotecnologia raggiunti negli ultimi due decenni, la biocatalisi, basata sullo sviluppo sostenibile e rispettosa dei principi della chimica verde, è una tecnologia sia verde che sostenibile.
L’ingegneria delle proteine ha consentito infatti l’ottimizzazione degli enzimi esistenti e l’invenzione di reazioni biocatalitiche completamente nuove che prima erano sconosciute in natura. Questo approccio è stato applicato con successo, ad esempio, nella sintesi industriale di principi attivi farmaceutici e di alcuni prodotti chimici di base.
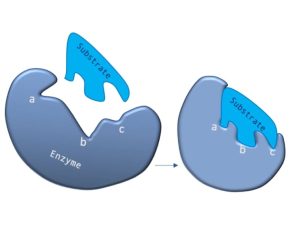
Come ogni catalizzatore, gli enzimi non vengono consumati dalle reazioni che catalizzano, né alterano l’equilibrio di queste reazioni. Tuttavia, gli enzimi differiscono dalla maggior parte degli altri catalizzatori in quanto sono altamente specifici per i loro substrati, simili a un meccanismo di serratura e chiave.
Biocatalisi e biocatalizzatori
Uno dei primi esempi di biocatalisi enzimatica moderna fu eseguito da Louis Pasteur nel 1858 che usò vari microrganismi come la muffa Penicillium glaucum in qualità di enzimi in una reazione di fermentazione al fine di produrre acido tartarico.
Tra i vantaggi offerti dai biocatalizzatori vi è l’elevata selettività nella produzione di singoli stereoisomeri, l’esclusione di reazioni secondarie, la diminuzione di operazioni di ritrattamento e purificazione e la sostenibilità del processo.
I biocatalizzatori, infatti, hanno mostrato un’elevata selettività e specificità nei confronti del loro substrato in condizioni blande rispetto a processi chimici che vengono eseguiti in condizioni molto difficili e portano a sottoprodotti collaterali indesiderati. Inoltre la natura biologica degli enzimi li rende meno pericolosi per la salute e meno tossici per l’ambiente rispetto ai catalizzatori chimici.

Per migliorare le prestazioni degli enzimi usati nella biocatalisi si usa la tecnica dell’immobilizzazione degli enzimi su supporti solidi inerti che può cambiare e migliorare alcune delle loro caratteristiche come, ad esempio, la loro stabilità. L’immobilizzazione degli enzimi consiste nello sviluppare legami covalenti tra l’enzima e il supporto che può essere realizzata anche tramite fenomeni di adsorbimento, che possono risultare allo stesso modo efficaci.
Questa tecnica, tuttavia, presenta alcuni svantaggi in quanto se il supporto non è poroso vi è una minore superficie di contatto enzima-substato mentre se esso è poroso può dare luogo a problemi di diffusione dei reagenti.
Applicazioni della biocatalisi
La biocatalisi ha trovato numerose applicazioni in vari campi in alternativa alla catalisi chimica. L’uso di enzimi nella sintesi organica, in particolare per produrre composti chirali per prodotti farmaceutici e per l’industria degli aromi e delle fragranze, sono gli esempi più importanti.
È stata applicata con successo in varie applicazioni della chimica verde, che vanno dai biocarburanti e bioplastiche ai prodotti farmaceutici e alla chimica fine. Ad esempio, tramite la biocatalisi si può produrre biodiesel da oli vegetali o grassi di scarto utilizzando lipasi, bioetanolo ottenuto da biomasse lignocellulosiche utilizzando cellulasi e microrganismi fermentanti.
Tramite processi biocatalitici si possono ottenere anche produrre bioplastiche, come i poliidrossialcanoati (PHA) o l’acido polilattico (PLA), da fonti rinnovabili utilizzando batteri o funghi.
Si possono infatti sintetizzare farmaci e intermedi, come antibiotici, steroidi o antivirali, utilizzando enzimi o cellule intere. La biocatalisi può anche creare prodotti chimici fini, come aromi, fragranze o coloranti, utilizzando ossidoreduttasi, idrolasi o transferasi.

Un esempio è costituito dalla isomerizzazione del glucosio in fruttosio che ha una maggiore dolcezza. La glucosio isomerasi è un enzima usato in campo industriale che catalizza l’isomerizzazione del D -glucosio nel D -fruttosio. Sebbene la conversione chimica del glucosio in fruttosio fosse nota da più di 100 anni i processi industriali mostrano problematiche relative all’elevato pH e alla temperatura di questo processo catalizzato da basi.
La reazione produce zuccheri non metabolizzabili e la concentrazione di fruttosio non poteva superare il 40%. La conversione enzimatica del glucosio in fruttosio, invece, produce una miscela equilibrata di glucosio e fruttosio costituita dal 42% fruttosio, 52% glucosio e 6% destrina che è più dolce del glucosio e ha la stessa dolcezza del saccarosio.
La biocatalisi può anche contribuire all’economia circolare, convertendo i flussi di rifiuti in prodotti di valore o consentendo la biodegradazione di composti. Può anche favorire l’innovazione e la scoperta, creando nuove molecole e materiali con nuove funzioni e proprietà e sostenere lo sviluppo sociale ed economico.



