Adsorbimento fisico e chimico- grafici
L’ adsorbimento è quel fenomeno in cui la superficie di una sostanza solida, detta adsorbente, fissa molecole provenienti da una fase gassosa o liquida con cui è a contatto
Quando una sostanza subisce il processo di ripartizione fra una fase gassosa o liquida e una fase solida si parla di adsorbimento. L’adsorbimento è un fenomeno complesso che coinvolge diversi tipi di interazioni che vanno dalle interazioni piuttosto deboli di tipo van der Waals alla formazione di veri e propri legami chimici dell’adsorbato con l’adsorbente.
Adsorbimento fisico e adsorbimento chimico
Si usa distinguere due tipi di adsorbimento:
– adsorbimento fisico con energie di interazione dell’ordine di grandezza di poche kcal/mol
– adsorbimento chimico quando le energie di interazione superano le 100 kcal/mol avvicinandosi alle energie in gioco nelle reazioni chimiche.
E’ importante distinguere tra i tipi di interazione che una molecola subisce venendo a contatto con una superficie solida. Si parla di adsorbente non specifico se le forze di interazione sono non direzionali e del tipo dette di dispersione. Tali forze dipendono dal numero di elettroni totali presenti nei livelli esterni della molecola adsorbita, ma non dal loro tipo. La natura chimica delle molecole non conta molto rispetto alle loro dimensioni e soprattutto rispetto alla loro polarizzabilità, ovvero alla possibilità di deformarsi sotto l’azione di un campo elettrico. Si formano, in tal modo dipoli istantanei indotti che sono responsabili dell’energia di adsorbimento.
Un adsorbente che agisce in questo modo viene detto non specifico.
Adsorbente specifico
Se, invece la natura dell’adsorbente è tale da poter formare con la molecola legami direzionali, di cui il caso più tipico è il legame a idrogeno, allora l’adsorbente si dice specifico e seleziona le molecole in base alla struttura chimica e non in base solo alle dimensioni della molecola.
Ovviamente i due tipi di interazioni coesistono nei comuni adsorbenti e la differenziazione fra questi ultimi è basata sulla prevalenza di uno o dell’altro tipo di interazioni. Esempi di adsorbenti non specifici sono il carbone attivo, la grafite e alcuni polimeri solidi, mentre carattere più specifico mostrano la silice e l’allumina.
Si consideri dapprima l’adsorbimento di un gas su un solido: la legge di ripartizione ha in genere nel caso dell’adsorbimento una validità più limitata di quanto non ne abbia nel caso della soluzione nei liquidi; l’isoterma di adsorbimento non solo non è lineare, ma presenta andamenti complessi che dipendono da vari fattori. Tuttavia il fatto più importante è che la superficie dell’adsorbente non è più la stessa dopo aver adsorbito un certo numero di molecole, cosicché le nuove molecole adsorbite interagiscono in maniera diversa dalle prime.
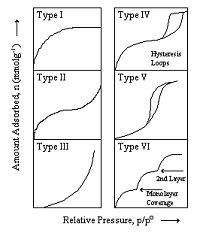
Se l’adsorbimento è notevole, si può, dopo la formazione di un monostrato di molecole adsorbite dalla superficie, arrivare alla condensazione, che avviene dapprima nei piccoli pori capillari presenti nell’adsorbente. I possibili tipi di isoterme di adsorbimento sono rappresentate in figura:
 Interpretazione del grafico
Interpretazione del grafico
La prima isoterma è tipica degli adsorbenti a struttura predominante microporosa in cui il riempimento dei micropori avviene a pressioni relative inferiori a 0.1 atm
La seconda isoterma è tipica dell’adsorbimento fisico di gas da parte di solidi non porosi
La terza isoterma si ottiene per deboli interazioni adsorbato-adsorbente ed è tipica sia di adsorbenti non porosi che microporosi.
Un ciclo di isteresi dovuto a condensazione capillare è una caratteristica comune del quarto tipo di isoterme la cui forma è unica per ciascun sistema di adsorbimento.
Le isoterme appartenenti al quinto tipo sono convesse rispetto all’asse della pressione e sono caratteristiche quando si verificano deboli interazioni adsorbato-adsorbente.
La forma delle isoterme appartenenti al sesto tipo è dovuta alla formazione di strati monomolecolari che si formano prima di un successivo strato.
La complessità delle isoterme di adsorbimento deriva dalla concomitanza di diversi tipi di interazioni e non sono rappresentabili da un’equazione generale. L’equazione più semplice è quella di Freundlich che rappresenta l’isoterma classica:
W/m = K(po)1/n
Dove W è il peso della sostanza adsorbita da un grammo di adsorbente, po è la pressione parziale del componente in esame, K un coefficiente che è pari al coefficiente di ripartizione se l’esponente 1/n = 1. In questo caso si ha un’isoterma lineare.
 Equazione di Langmuir
Equazione di Langmuir
Langmuir, partendo dall’ipotesi che le molecole formino un solo strato monomolecolare ha proposto l’equazione:
W/m = K1K2po/ 1 + K1po
In cui W, m e po hanno il significato già detto e K1 e K2 sono coefficienti sperimentali.
L’equazione più generale in grado di soddisfare le sei isoterme viste in precedenza è quella ricavata da Brunauer, Emmett e Teller (BET):
p/po/ Vs( 1 – po/p) = 1 / VmE + E-1/ VmE po/p
in cui po è la pressione parziale della sostanza adsorbita, p la sua tensione di vapore alla temperatura dell’esperimento, Vs è il volume della sostanza adsorbita e Vm è il volume corrispondente alla quantità adsorbita per formare un monostrato, mentre per E vale l’equazione:
E = exp (ΔHa – ΔH1) / RT
Dove ΔHa è il calore di adsorbimento al monostrato e ΔH1 è il calore di liquefazione dell’adsorbato. Dalla prevalenza di ΔHa su ΔH1 dipende l’andamento dell’isoterma.
Per quanto riguarda l’influsso della temperatura sull’adsorbimento, se non si verificano reazioni chimiche con la superficie dell’adsorbente, l’entità del fenomeno diminuisce con la temperatura. Questo è in accordo con il Principio di Le Chatelier dato che l’adsorbimento è sempre accompagnato da sviluppo di calore.