Riduzione di Meerwein-Ponndorf-Verley
La riduzione di Meerwein-Ponndorf-Verley nota come MPV Reduction consiste nella riduzione del gruppo carbonilico presente in aldeidi e chetoni con formazione, rispettivamente di alcoli primari e secondari. La reazione è altamente selettiva e interessa esclusivamente il gruppo carbonilico senza interagire e non coinvolge altri gruppi funzionali e ciò costituisce il grande vantaggio di questa reazione rispetto all’uso di agenti riducenti a base di idruri metallici.
La riduzione di Meerwein-Ponndorf-Verley è considerata come l’opposto dell’ossidazione di Oppenauer in cui gli alcoli secondari sono ossidati a chetoni e gli alcoli secondari sono ossidati ad aldeidi tramite un’ossidazione selettiva. Insieme le due reazioni sono denominate reazioni MPVO.

Negli anni ’20, tre ricercatori, indipendentemente l’uno dall’altro effettuarono la riduzione dei composti carbonilici utilizzando alcossidi di alluminio. Nel 1925, il chimico tedesco Hans Meerwein ridusse con successo le aldeidi in presenza di etossido di alluminio e, nello stesso anno, il francese Albert Verley ridusse i chetoni utilizzando sia etossido di alluminio che isopropossido.
Successivamente, nel 1926, il chimico tedesco Wolfgang Ponndorf scoprì che la riduzione sia delle aldeidi che dei chetoni poteva avvenire in presenza di una varietà di alcossidi metallici ed era anche completamente reversibile. Successivamente, la riduzione di aldeidi e chetoni utilizzando alcossidi metallici come l’isopropossido di alluminio divenne nota come riduzione Meerwein-Ponndorf-Verley.
Meccanismo della riduzione di Meerwein-Ponndorf-Verley
La reazione avviene in presenza di un acido di Lewis, generalmente un alcossido di alluminio e di un alcol detto sacrificale. Nella fase iniziale l’ossigeno alcolico attacca l’acido di Lewis legandosi al metallo che espelle il gruppo -RO–.
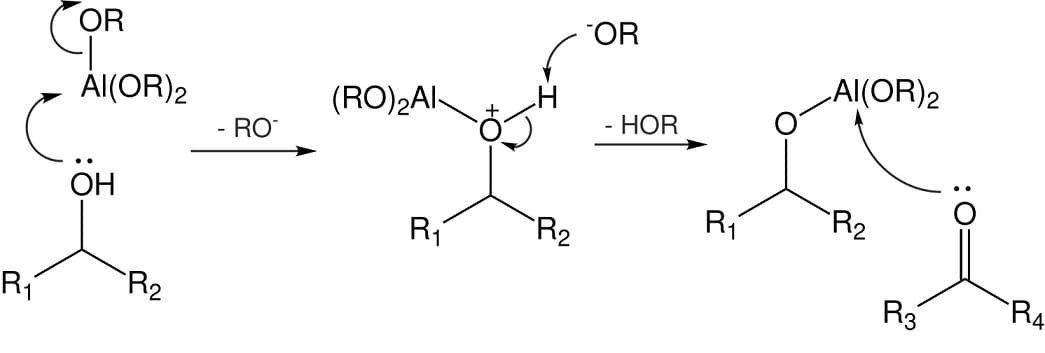
Quest’ultimo attacca l’idrogeno legato all’ossigeno caricato positivamente con formazione di un alcol. A questo punto della reazione l’ossigeno del gruppo carbonilico attacca l’acido di Lewis con formazione di uno stato di transizione ciclico a sei membri in cui avviene il transfer dell’idruro dall’alcossido al carbonio del gruppo carbonilico.

Questa reazione è chemoselettiva, si svolge in condizioni di reazione blande, ha semplicità operativa e basso costo. Non coinvolge altri gruppi funzionali come doppi legami o tripli legami così come su altri composti carbonilici enolizzabili come β-chetoesteri o β-dichetoni.
Può quindi essere utilizzata nella preparazione di alcol chirali che sono largamente utilizzati in chimica farmaceutica e industriale
Nuove prospettive
Gli alcoli rappresentano molecole strutturali versatili nei campi della chimica fine, dei prodotti agrochimici e farmaceutici. Nel campo della chimica verde, la ricerca di metodi sempre più ecologici ed economicamente sostenibili per trasformare aldeidi e chetoni in alcoli riveste un’importanza fondamentale.
La possibilità di ottenere un bioalcol aumenta la sostenibilità del processo. Infatti sono già stati sviluppati diversi processi per produrre alcol, come metanolo, etanolo, propanolo e butanolo da bio-syngas o carboidrati e fermentazione di biomassa
La ricerca si è quindi indirizzata verso nuovi approcci per la riduzione di aldeidi e chetoni in alcoli indotti dalla luce. In particolare un metodo utilizza l’isopropanolo sia come solvente di reazione che come agente riducente, in presenza di t-BuOK.
Questo approccio operativamente semplice, promosso dalla luce, segue il percorso di riduzione Meerwein-Ponndorf-Verley e si rivela efficace per generare vari derivati dell’alcol benzilico. La riduzione di Meerwein-Ponndorf-Verley è una reazione di equilibrio pertanto, viene solitamente spostato a destra utilizzando un eccesso del donatore di idrogeno. Questo è il motivo per il quale in molti processi liquidi l’alcol viene utilizzato sia come reagente che come solvente.
Nella reazione classica, che utilizza comunemente l’isopropossido di alluminio, si forma uno stato di transizione ciclico a sei membri per consentire il rilascio di un idruro da un carbonio. Le variazioni sul tema includono la sostituzione dell’isopropossido di alluminio con gli ossidi di samario (IV) e zirconio (IV)
Questa reazione è particolarmente adatta per la riduzione di aldeidi e chetoni insaturi, rispetto alle riduzioni catalitiche con idrogeno molecolare utilizzando catalizzatori di metalli nobili. La riduzione di Meerwein-Ponndorf-Verley è stata tradizionalmente condotta utilizzando catalizzatori omogenei come alcossidi di alluminio o titanio.
Tuttavia, negli ultimi due decenni, è stato pubblicato un numero crescente di pubblicazioni in cui sono presenti catalizzatori eterogenei. Questo interesse è stimolato dai vantaggi della catalisi eterogenea rispetto a quella omogenea, in particolare per applicazioni su larga scala. Uno dei principali vantaggi della riduzione di Meerwein-Ponndorf-Verley che avvengono secondo una catalisi eterogenea è che il catalizzatore può essere facilmente separato dalla miscela di reazione liquida.
Sono quindi stati utilizzati ossidi metallici come l’ossido di magnesio, il biossido di zirconio, il biossido di silicio e l’ossido di alluminio e alcossidi di Al, La, Zr e Hf innestati su materiali mesoporosi ad elevata area superficiale e zeoliti.



