L’idroborazione degli alcheni- Chimica organica
L’idroborazione è quella reazione organica in cui il borano BH3 si addiziona a legami insaturi di alcheni e alchini per dare un boroalchile, importante intermedio di sintesi dal quale è possibile preparare numerosi altri composti.
Il boro ha numero atomico pari a 5 e quindi la sua configurazione elettronica è 1s2, 2s2, 2p1. A seguito della promozione dell’elettrone dall’orbitale 2s all’orbitale 2p il boro ha 3 elettroni spaiati, forma tre orbitali ibridi sp2 e, coerentemente con la teoria V.S.E.P.R., dispone i suoi orbitali planarmente secondo angoli di 120°.
Legandosi all’idrogeno forma il borano che è una specie elettron-deficiente, quindi un potente acido di Lewis capace di condurre attacchi elettrofili in quanto il boro è contornato da soli sei elettroni. Stante la maggior elettronegatività dell’idrogeno rispetto al boro il legame boro-idrogeno si presenta polarizzato Bδ+– H δ- in modo inverso rispetto agli acidi alogenidrici.
Regola di Markovnikov
Per tale motivo la reazione ha selettività anti-Markovnikov con il boro che si lega al carbonio meno sostituito e l’idrogeno che si lega al carbonio più sostituito.
La regola di Markovnikov, correttamente enunciata dice che l’agente che conduce l’attacco elettrofilo si lega al carbonio meno sostituito (più idrogenato) .
Dal momento che, in genere, come negli acidi alogenidrici è l’idrogeno che detiene una parziale carica positiva, si suole enunciare tale regola dicendo che l’idrogeno si lega al carbonio meno sostituito ( più idrogenato) per cui erroneamente molti dicono che l’idroborazione è una reazione anti-Markovnikov. Tale reazione in realtà rispetta la regola di Markovnikov ma dà un prodotto anti-Markovnikov. L’idroborazione avviene in tre stadi e, considerando ad esempio la reazione dell’ etene con il borano, si ha:
1) CH2=CH2 + BH3 → CH3CH2BH2
2) CH3CH2BH2 + CH2=CH2 →(CH3CH2)2BH
3) (CH3CH2)2BH + CH2=CH2 → (CH3CH2)3B
Il prodotto della reazione è il trietilborano. Ovviamente, poiché nell’etene entrambi gli atomi di carbonio sono parimenti idrogenati non è applicabile la regola di Markovnikov. L’addizione del borano avviene in maniera concertata e sia il boro che l’idrogeno si legano dalla stessa parte del doppio legame (addizione syn) o anche detta reazione stereospecifica in cis.
Meccanismo di idroborazione
Il meccanismo di idroborazione è evidenziato nell’immagine:
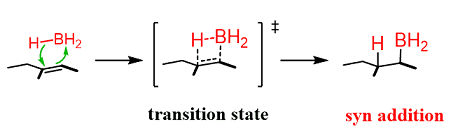
I solventi usati per la reazione sono gli eteri, particolarmente il tetraidrofurano e il glicole etilenico, dimetiletere . L’idroborazione, non prevedendo carbocationi intermedi, non dà fenomeni di trasposizione o riarrangiamenti.
Con alcheni asimmetrici come l’1-butene la reazione procede, in base a quanto detto, con formazione del tri-n-butilborano. Il boro si addiziona infatti al carbonio meno sostituito. La reazione può essere scritta :
3 CH2=CHCH2CH3 + BH3 → (CH3CH2CH2CH2)3B
L’utilità di tale reazione risiede nel fatto che i prodotti hanno grande importanza costituendo intermedi di sintesi: una delle reazioni più importanti degli alchilborocomposti è l’ossidazione con perossido di idrogeno in ambiente basico che porta al corrispondente alcol. La reazione generale è:
R3B + 3 H2O2 = 3 R-OH + B(OH)3
e, nel caso specifico del tri-n-butilborano, tale reazione è:
(CH3CH2CH2CH2)3B + 3 H2O2 → 3 CH3CH2CH2CH2OH + B(OH)3
Nello specifico il prodotto della reazione è il butan-1-olo.
Il meccanismo dell’idroborazione-ossidazione è riportato nella figura:
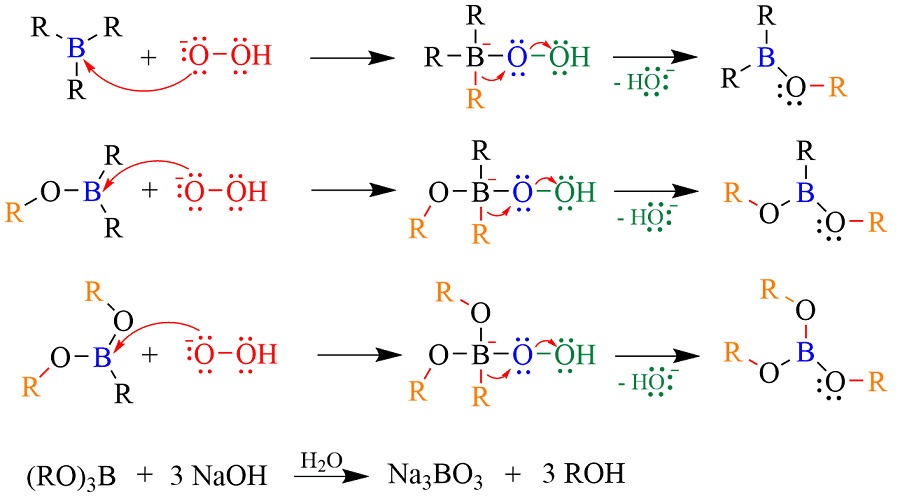
Va evidenziato che se si fosse fatta l’idratazione dell’1-butene in ambiente acido il prodotto di reazione sarebbe stato il butan-2-olo in quanto tale reazione avviene con l’attacco elettrofilo dello ione H+ e con conseguente formazione del carbocatione intermedio. Le sintesi di alcuni composti può trovare una soluzione tramite l’idroborazione.
Diborano
Evidenze sperimentali, tuttavia ci indicano che il borano, in realtà esiste solo nella forma dimera diborano B2H6 che appare una molecola atipica non rappresentabile secondo le regole di Lewis e quindi si deve ammettere che esistano legami non convenzionali.
Gli elettroni di legame coinvolti nella molecola sono 12 ( tre per ciascun atomo di boro e uno per ogni idrogeno) .

Ciascun atomo di boro condivide due elettroni con due atomi di idrogeno per cui sono stati sfruttati otto dei dodici elettroni disponibili e quindi si deve ammettere che i due atomi di idrogeno che si dispongono “a ponte” distribuiscono la coppia elettronica di legame fra entrambi gli atomi di boro, così da formare un legame a tre centri come è evidenziato in figura:



