Il cicloesano: analisi conformazionale
Il cicloesano è uno dei composti ciclici più noti che e può presentarsi in una conformazione a sedia che si interconverte con la conformazione a barca, Il cicloesano è un prodotto naturale trovato in Helichrysum odoratissimum e Terminalia chebula.
Il cicloesano è uno dei cicloalcani che ha una particolare importanza, specie in relazione alla sua conformazione.
I composti ciclici privi di doppi legami hanno formula generale CnH2n e pertanto il cicloesano ha formula C6H12.
Conformazione a sedia del cicloesano
Il conformero stabile di questo composto ciclico è chiamato forma a sedia
Questo conformero è rigido, nel senso che un cambiamento di un angolo diedro fra un qualunque legame e un altro impone simultaneamente dei cambiamenti in uno o più angoli di legame nella molecola.
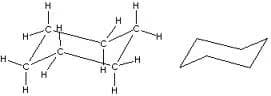
Nella conformazione a sedia gli idrogeni possono essere divisi due classi equivalenti idrogeni assiali e idrogeni equatoriali. Se procediamo lungo l’anello troviamo alternativamente un idrogeno assiale Ha che punta verso l’alto e il successivo che punta verso il basso e così via.
Gli idrogeni equatoriali He si trovano tutti sul piano generale della molecola e alternativamente puntano anch’essi verso l’alto e verso il basso. Se l’idrogeno assiale punta verso l’alto, l’idrogeno equatoriale dello stesso atomo di carbonio punta verso il basso e viceversa.
Esiste anche un’altra conformazione possibile per il cicloesano che viene indicata a barca. E’ energeticamente sfavorita tuttavia una debole quantità di forma a barca è in equilibrio con la forma a sedia a temperatura ambiente e l’equilibrio viene raggiunto velocemente.
Consideriamo una conformazione a sedia e concentriamo la nostra attenzione sugli idrogeni assiali, vediamo che si può voltare all’insù l’angolo a sinistra della sedia ottenendo la forma a barca. E’ possibile rovesciare anche l’altro carbonio all’estremità destra della molecola e passare così all’altra conformazione a sedia.
Tali due strutture a sedia sono indistinguibili ma è necessario sottolineare che nel passare dalla prima alla seconda sedia gli idrogeni assiali presenti nella prima sono diventati equatoriali nella seconda.
Mentre la forma a sedia è assai rigida, quella a barca non lo è altrettanto e può flettersi in quelle che sono chiamate forme intrecciate (twisted) .
Le rigide forme a sedia e quelle flessibili a barca non sono isolabili con tecniche grossolane come la distillazione frazionata in quanto esse si interconvertono rapidamente.
Conformazione a barca
L’energetica dell’interconversione delle due forme a sedia del cicloesano attraverso la forma a barca può essere riassunta nel diagramma della coordinata di reazione mostrato in figura:

Nei cicloesani monosostituiti, come il metilcicloesano mostrato in figura

Esiste un equilibrio secondo il quale solamente due conformeri sono presenti in quantità apprezzabili. Questi sono due conformeri a sedia in cui il gruppo metilico è o in posizione assiale o in posizione equatoriale.
I due conformeri, assiale ed equatoriale, hanno energia diversa : infatti il metilcicloesano con il gruppo metilico in posizione equatoriale risulta essere più stabile perché manca la tensione sterica tra un sostituente assiale e gli altri due legami assiali (anche se si tratta di idrogeni) che invece è presente nell’altro conformero.
Occorre tener presente che i conformeri assiali ed equatoriali sono interconvertibili, poiché una conformazione a sedia può essere convertita in una conformazione a barca e questa in un’altra conformazione a sedia in cui le precedenti posizioni assiali sono diventate equatoriali e viceversa.
La barriera di energia di questo processo è circa 11 kcal/mol che rappresenta l’energia necessaria per trasformare la conformazione a sedia in una a barca. Ciò significa che il processo si svolge a temperatura ambiente con grande velocità in quanto richiede complessivamente 15-20 kcal/mol.
La maggior parte delle molecole del metilcicloesano saranno nella conformazione in cui il metile è equatoriale, tuttavia in ogni dato istante ve ne saranno alcune con il metile assiale stante l’esigua differenza di energia.
Si riporta in tabella la differenza di energia assiale-equatoriale per alcuni sostituenti comuni.
| Sostituente | Δ kcal/mol |
| – CH3 | 1.7 |
| – CH2CH3 | 1.8 |
| – C(CH3)3 | Molto grande |
| – C6H5 | 3.1 |
| – COOR | 1.1 |
| – OH | 0.7 |
| – Cl, – Br, -I | 0.5 |
C’è da notare che il gruppo terz-butilico è così ingombrante che non gli è possibile stare in posizione assiale al punto che esso viene impiegato per “bloccare” un cicloesano sostituito in una delle due possibili conformazioni a sedia, quella appunto in cui il gruppo terz-butilico è in posizione equatoriale.



