Determinazione degli amminoacidi in una proteina
Per la determinazione degli amminoacidi in una proteina, un campione altamente purificato viene idrolizzato in condizioni acide nei suoi amminoacidi costituenti. La composizione amimnoacidica della proteina è determinata dalle concentrazioni dei singoli aminoacidi e dal peso molecolare della proteina.
Per la determinazione della sequenza ordinata degli amminoacidi presenti in una proteina è fatta un’analisi per la determinazione sia qualitativa che quantitativa degli amminoacidi presenti. Il metodo consiste di due fasi:
1) Idrolisi di una quantità nota di proteina
2) Separazione degli amminoacidi
Fasi della determinazione degli amminoacidi in una proteina
Idrolisi
L’idrolisi è fatta riscaldando la proteina a 100-100 gradi centigradi in HCl 6 N per un tempo di circa 24 ore. Le proteine contenenti molti gruppi idrofobi ingombranti possono richiedere un tempo maggiore.
Il triptofano, tuttavia, è sensibile agli acidi ed è parzialmente distrutto nell’idrolisi, fenomeno che si deve tener presente nell’analisi quantitativa. Inoltre, se vi sono glutammina e asparagina si isola ammoniaca , acido glutammico e acido aspartico.
Separazione
La miscela di amminoacidi ottenuta per idrolisi può essere separata e analizzata usando tecniche cromatografiche. Nell’analizzatore sono introdotte delle aliquote della miscela di amminoacidi dentro colonne separate costituite da resine a scambio ionico. Una colonna è mantenuta a pH 5.3 e viene usata per la determinazione degli amminoacidi basici, per l’ammoniaca e il triptofano.
Una seconda colonna è mantenuta a pH 3.25 per gli altri amminoacidi fino a che sono passati da 0 a 250 mL di eluente. Quindi il pH è aumentato fino a pH pari a 4.25 facendo passare da 250 a 500 mL di eluente. Si eluiscono poi gli acidi fissati nella colonna con una soluzione tampone di citrato di sodio e le soluzioni così eluite sono mescolate con ninidrina e poi scaldate.
La ninidrina è un indicatore altamente specifico per il rilevamento degli amminoacidi in quanto reagisce con essi dando una colorazione azzurro-violetto ( assorbimento a 570 nm), tranne che con la prolina che, essendo un amminoacido ciclico e presentando quindi un’ammina secondaria forma con la ninidrina un complesso giallo (assorbimento a 440 nm). La reazione tra la ninidrina e un amminoacido avviene secondo il seguente schema:
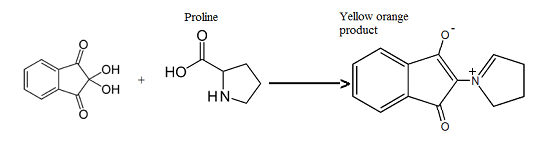
Una volti separati i vari amminoacidi, dopo il trattamento con la ninidrina si presentano di colorazioni diverse a seconda dell’amminoacido che ha reagito:

Analisi spettrofotometrica
La determinazione degli amminoacidi in una proteina si può ottenere tramite uno spettrofotometro che misura l’assorbimento ottico dei prodotti di reazione con la ninidrina e un registratore riporta in continuo i millilitri di eluato contro l’intensità del colore della ninidrina.
La posizione del picco di assorbimento che dipende dal volume di soluzione tampone necessario per eluire un determinato amminoacido è caratteristica per ciascun amminoacido il che consente un’analisi qualitativa. Inoltre poiché la concentrazione di ciascun amminoacido è proporzionale all’assorbanza della soluzione, le rispettive quantità sono ottenute dalla misura dell’area sottostante il picco (analisi quantitativa)
Dalla figura si possono osservare i picchi caratteristici di alcuni amminoacidi




