Anilina: sintesi, meccanismo
L’anilina è una sostanza di primaria importanza dell’industria chimica utilizzata per la sintesi del difenilmetano diisocianato impiegato nella sintesi dei poliuretani e costituisce un intermedio per l’ottenimento di coloranti, prodotti farmaceutici e agenti vulcanizzanti.
L’anilina, isolata per la prima volta nel 1826 da Otto Unverdorben mediante distillazione distruttiva dell’indaco, è un’ammina primaria aromatica. Mostra pertanto carattere basico e il valore di Kb è pari 4.3 · 10-10. Tuttavia questo valore è notevolmente inferiore a quello delle ammine alifatiche come, ad esempio, la metilammina per la quale il valore di Kb è pari a 4.38 ·10-4.
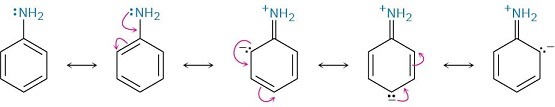
Le arilammine sono meno basiche delle alchilammine perché gli elettroni della coppia solitaria dell’azoto sono delocalizzati dall’interazione con il sistema di elettroni π dell’anello aromatico e sono meno disponibili per il legame con H +. In termini di risonanza, le arilammine sono stabilizzate rispetto alle alchilammine a causa delle loro cinque forme di risonanza.
Sintesi dell’anilina
Può essere sintetizzata in due stadi successivi: nitrazione del benzene e successiva riduzione del nitrobenzene ad anilina.
Per la nitrazione del benzene si deve ottenere lo ione nitronio NO2+ che, essendo instabile, va generato in situ. Si fanno pertanto reagire l’acido solforico e l’acido nitrico ; l’acido solforico è più forte dell’acido nitrico pertanto agisce da acido perdendo un protone e protonando l’acido nitrico:
H2SO4 + HNO3 → HSO4– + H2NO3+
H2NO3+ → NO2+ + H2O
Lo ione nitronio è attaccato dal benzene con formazione di un intermedio stabilizzato per risonanza in cui la carica positiva si localizza in posizione orto e para rispetto al nitrogruppo.
L’ossigeno dell’acqua estrae l’idrogeno legato al carbonio a cui a sua volta è legato il nitrogruppo con formazione di nitrobenzene e H3O+
Per ridurre il nitrobenzene si utilizza acido cloridrico concentrato e stagno con formazione dello ione fenilammonio. La semireazione di riduzione è:
C6H5NO2 + 7 H+ + 6 e– → C6H5NH3+ + 2 H2O
Lo stagno si ossida sia a stagno (II) che a stagno (IV) secondo le semireazioni di ossidazione:
Sn → Sn2+ + 2 e–
Sn2+ → Sn4+ + 2 e–
Per allontanare uno ione H+ dal fenilammonio la soluzione viene trattata con idrossido di sodio secondo la reazione:
C6H5NH3+ + OH– → C6H5NH2 + H2O
La fenilammina deve essere successivamente separata dagli altri prodotti di reazione quali i composti dello stagno. Si deve quindi procedere a una distillazione in corrente di vapore, estrazione con solvente e successiva ulteriore distillazione.




