Alogenazione del benzene sostituito: alogenazione della catena laterale
L’alogenazione del benzene sostituito dipende dal sostituente e se esso è un attivante si ottengono teoricamente numerosi prodotti di reazione
Consideriamo in particolare la bromurazione dell’etilbenzene che contiene il gruppo etil- che è un attivante orto-para direttore
Si potrebbe ipotizzare che tra i prodotti di reazione vi siano quelli in cui è stata alogenata la catena laterale ovvero l’1-bromo, 2-feniletano e il 2,bromo,2,feniletano che, presentando un carbonio asimmetrico può essere presente come isomero L e come isomero D:
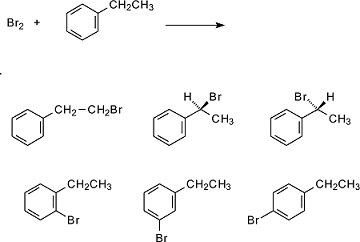
L’altro prodotto di reazione è in tutti i casi HBr.
Vi sono quindi, in linea teorica, sei possibili prodotti di reazione in ognuno dei quali un atomo di idrogeno è stato sostituito da un atomo di bromo ovvero avviene una rottura di un legame C-H e la formazione di un legame C-Br.
Il prodotto della reazione è conseguente alle condizioni di reazione: se la reazione è condotta infatti se la reazione avviene in presenza di FeBr3 non avviene l’alogenazione della catena laterale e la reazione procede con lo stesso meccanismo dell’alogenazione del benzene dando, come prodotti principali ottenere l’o-bromo,etilbenzene e il p-bromo,etilbenzene.
Alogenazione della catena laterale
Se si vuole ottenere l’alogenazione della catena laterale è quindi necessario ipotizzare altre condizioni di reazione.
Il bromo molecolare Br-Br ha un legame relativamente debole che può essere rotto o termicamente erogando la quantità di energia pari a 192 kJ/mol necessaria a rompere il legame oppure in presenza di luce.
In entrambi i casi avviene la scissione omolitica del legame Br-Br che dà luogo alla formazione del radicale Br·:
Br2 → 2 Br·
Il radicale, non avendo l’ottetto completo, è altamente reattivo e potrebbe andare a sostituire indifferentemente uno degli idrogeni in posizione orto, meta o para oppure un idrogeno della catena laterale presente sul gruppo – CH3 o sul gruppo CH2.
Per poter prevedere quale idrogeno è sostituito si possono considerare le entalpie di dissociazione del legame C-H nei casi considerati: l’entalpia di dissociazione degli idrogeni in posizione orto, meta o para è pari a + 473 kJ/mol, l’entalpia di dissociazione C-H del gruppo –CH3 è di 410 kJ/mol mentre l’entalpia di dissociazione del legame C-H del gruppo –CH2 è di 356 kJ/mol.
Si può quindi prevedere la selettività calcolando la variazione di entalpia nei vari casi che è data dalla differenza tra l’entalpia di dissociazione del legame C-H e l’entalpia di formazione del legame H-Br che vale 368 kJ/mol.
C-H aromatico : + 473 – 368 = + 105 kJ/mol
-CH3 : + 410 – 368 = + 42 kJ/mol
-CH2 : 356 – 368 = – 12 kJ
Aspetto termodinamico
Da questi dati termodinamici si può comprendere che l’unica reazione entalpicamente favorita è l’ultima ovvero quella in cui il bromo sostituisce l’idrogeno del gruppo –CH2
A questo punto della reazione si è rotto il legame Br-Br, si è rotto il legame C-H e si è formato il legame H-Br. A questo punto si deve formare il legame C-Br da parte del carbonio radicalico presente nella catena laterale bel benzene e la molecola di Br2 che avviene secondo il meccanismo:

L’energia di questo processo è data dalla differenza tra l’energia di formazione del legame C-Br pari a 293 kJ/mol e l’energia necessaria a rompere il legame Br-Br pari a 192 kJ/mol. Tale differenza vale 101 kJ/mol e pertanto ΔH° = – 101 kJ/mol
Calcoliamo ora la variazione di entalpia dovuta all’intero processo:
C-H aromatico : + 105 – 101 = 4 kJ/mol
-CH3 : + 42 – 101 = – 59 kJ/mol
-CH2 : – 12 – 101 = – 113 kJ/mol a cui corrisponde la reazione energeticamente più favorita.
Il prodotto principale della bromurazione dell’etilbenzene è quindi il 2,bromo,2,feniletano



