Spettri e strutture atomiche o molecolari
Lo studio degli spettri consente di individuare una specie chimica in quanto un atomo può emettere emettere o assorbire determinate lunghezze d’onda
La materia può assorbire o emettere energia sotto forma di radiazione elettromagnetica.
Il range della frequenze caratteristiche della radiazione che sono assorbite o emesse sono visualizzate in uno spettro; questo fornisce importanti informazioni sulla struttura della materia ed è usato per caratterizzare e identificare una sostanza. Le onde di una radiazione sono caratterizzate da una frequenza ν e da una lunghezza d’onda λ. La loro velocità di propagazione è pari a λν = c = 2.988 ∙ 108 m/s. Alcune proprietà della radiazione possono essere spiegate in termini di particelle dette fotoni. Esse hanno energia pari a E = hν dove h = 6.626 ∙ 10-34 J ed è detta costante di Planck.
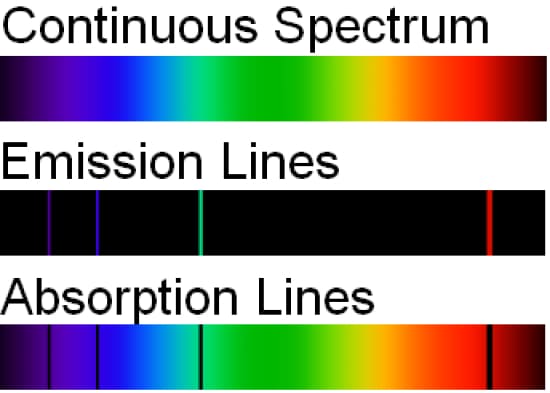
Spettri a righe
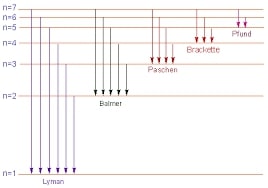
Quando un elemento è riscaldato ad alta temperatura o eccitato in un tubo a scarica, si ottiene spettri a righe. Niels Bohr riuscì a prevedere le lunghezze d’onda delle righe nello spettro dell’idrogeno dalla sua teoria secondo la quale ogni singolo elettrone appartiene ad un orbita con un determinato livello energetico e un proprio raggio.
L’assorbimento di una energia quantizzata consente all’elettrone di essere promosso da un livello a energia più bassa a un livello a energia più alta, mentre l’emissione di una determinata energia corrisponde al passaggio di un elettrone da un orbita ad energia maggiore a un’orbita a energia minore. Sebbene la teoria di Bohr risulti quantitativamente accurata solo per l’atomo di idrogeno i concetti enunciati possono essere utilizzati per altri atomi e per altre molecole.
Quando la radiazione ha una lunghezza d’onda che cade nel campo del visibile tali transizioni sono osservabili, tuttavia, transizioni correlate a una lunghezza d’onda maggiore o minore possono dare rispettivamente radiazioni infrarosse e ultraviolette.
Ogni atomo ha una sua specifica configurazione elettronica quindi gli elettroni si troveranno in determinati livelli energetici pertanto avrà uno specifico spettro. Si noti che le tecniche sia di assorbimento che di emissione possono essere usate e danno le stesse informazioni in relazione ai livelli energetici degli atomi.
Applicazioni
Si supponga di avere un gas in un contenitore di vetro e che la spettro dia una linea di assorbimento a 642 nm. Se si vuole determinare se tale gas è idrogeno. Si può procedere calcolando a quali due livelli energetici corrisponde questa transizione,
L’energia è data da E = hc/λ = (6.63 ∙ 10-34 ) ( 3 ∙ 108) / 642 x 10-9 m = 3.1 ∙ 10-19 J
Tenendo conto che 1 J = 6.24 ∙ 1019 eV si ha che l’energia è pari a (6.24 ∙ 1019 eV )(3.1∙ 10-19J) / 1 J = 1.9 eV
Si noti, dalla figura in cui vengono riportati alcuni livelli energetici dell’atomo di idrogeno
che le transizioni che corrispondono a tale linea avente l’energia calcolata vanno dal livello 2 a quello 3 quindi:
E2,3 = E2 – E3 = 3.40 – 1.51 = 1.9 eV ( considerando 2 cifre significative)
Quindi l’energia che un elettrone deve assorbire per passare dal livello 2 al livello 3 è di 1.9 eV. Essa è la stessa di quella assorbita dal gas. Ciò conferma che il gas presente è appunto l’idrogeno.
Composti organici
Nei composti organici alcuni gruppi di atomi vibrano alla stessa frequenza a prescindere dal quale molecola essi si trovano. In particolare molti gruppi funzionali possono essere identificati dalle frequenze caratteristiche che essi assorbono nella regione dell’infrarosso. Quando le molecole assorbono nel campo del visibile o dell’UV si presentano spettri a banda. L’energia assorbita, infatti, non interessa solo l’eccitazione degli elettroni, ma viene in parte assorbita per aumentare l’energia vibrazionale e rotazionale pertanto i fotoni vengono assorbiti in un vasto range di frequenze e lunghezze d’onda.
La teoria più rispondente alla previsione delle energie degli elettroni contenuti nelle molecole è quella dell’orbitale molecolare secondo la quale gli elettroni occupano orbitali non correlati a un singolo atomo ma sono distribuiti sull’intera molecola. Gli orbitali molecolari di legame comportano un’interferenza costruttiva tra due onde elettroniche. Gli orbitali molecolari di antilegame comportano una interferenza distruttiva. Gli elettroni che si trovano in un orbitale di antilegame annullano l’effetto degli elettroni che si trovano in un orbitale di legame e ciò spiega il motivo per il quale non si forma la molecola He2.
Maggiore è la delocalizzazione elettronica più bassa è la separazione tra i livelli energetici. Maggiore è la lunghezza d’onda alla quale avviene l’assorbimento. I composti che contengono lunghe catene contenenti doppi legami alternati assorbono nel campo del visibile e appaiono colorati.