Regola della diagonale o regola di Madelung: numeri quantici
La regola della diagonale o regola di Madelung dal nome del fisico tedesco Erwin Madelung consente di prevedere l’ordine di riempimento degli orbitali per avere la configurazione elettronica degli elementi.
Vi sono tuttavia eccezioni alla regola della diagonale in quanto alcuni elementi sono più stabili con meno elettroni in alcuni sottolivelli e più elettroni in altri.
Numeri quantici
Ogni elettrone è caratterizzato da quattro numeri quantici:
1) Numero quantico principale correlato all’energia dell’orbitale cioè dalla distanza dell’elettrone dal nucleo. Esso assume valori interi che vanno da 0 a 7. Questo numero si indica con (n)
2) Numero quantico secondario correlato alla forma dell’orbitale esso assume valori interi che vanno da 0 a n – 1. Il numero quantico secondario si indica con (l)
Se n = 1 allora l = 0 e l’orbitale è di tipo (s)
Per n = 2 allora l = 1 e l’orbitale è di tipo (p)
Se n = 3 allora l = 2 e l’orbitale è di tipo (d)
Se n = 4 allora l = 3 e l’orbitale è di tipo (f)
3) Numero quantico magnetico correlato all’orientazione dell’orbitale nello spazio. Esso assume valori che vanno da – l a + l compreso lo zero. Questo numero si indica con (m)
4) Numero quantico di spin. Definisce il movimento rotatorio degli elettroni. Esso assume due valori possibili + ½ e – ½ che definiscono il movimento di rotazione degli elettroni intorno al proprio asse in senso orario e antiorario.
Configurazione elettronica
Per scrivere la configurazione elettronica di un elemento si parte dall’orbitale 1s in cui si trovano 2 elettroni 1s2 e successivamente l’orbitale 2 s in cui si trovano 2 elettroni 2s2. Poi si riempei l’orbitale 2p che può contenere 6 elettroni: 2p6 e quindi l’orbitale 3s avendosi 3s2 e continuando 3p6.
Quando il numero quantico principale vale 3 i possibili valori di l sono: 0, 1 e 2. Quindi l’orbitale successivo al 3p dovrebbe essere il 3d mentre viene riempito prima il 4s: lo scandio che ha 21 elettroni ha quindi configurazione 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d1.
Per ricavare la configurazione elettronica di un elemento ci si può avvalere della regola diagonale secondo la quale gli elettroni si dispongono in ordine crescente secondo la somma dei numeri quantici n e l:
l’orbitale 4s ha numero quantico principale uguale a quattro e numero quantico secondario uguale a zero pertanto la somma n + l = 4 + 0 = 4; l’orbitale 3d ha numero quantico principale uguale a 3 e numero quantico secondario uguale a 2 pertanto la somma n + l = 3 + 2 = 5. Gli elettroni quindi si disporranno andando ad occupare per primo l’orbitale per il quale la somma n+l è minore.
Riempimento degli orbitali e regola della diagonale
Secondo le regola della diagonale se la somma dei due numeri quantici è la stessa allora verrà occupato per primo l’orbitale in cui n ha valore più basso. Ad esempio vediamo cosa accade per l’orbitale 4p e 5s: l’orbitale 4p ha numero quantico principale uguale a 4 e numero quantico secondario uguale a 1 quindi n + l = 4 + 1 = 5.
L’orbitale 5s ha numero quantico principale uguale a 5 e numero quantico secondario uguale a zero quindi n + l = 5 + 0 = 0. Questo è proprio il caso in cui la somma di n e l è la stessa. Poiché n ha valore più basso nell’orbitale 4p rispetto a 5s allora l’ordine di riempimento è 4p e poi 5s. scriviamo quindi, alla luce delle considerazioni fatte la configurazione elettronica dello Xeno che ha 54 elettroni: iniziamo a scrivere 1s2 2s2 2p6 3s2 3p6 4s2 3d 10 4p6 5s2 avendo già trovato posto 38 elettroni.
Dopo il 5s, si ha il 4d in cui la somma di n+ l vale 4 + 2 = 6 e poi il 5 p in cui n + l = 5 + 1 = 6 che segue il 4d in quanto ha numero quantico maggiore: si ha quindi:
1s2 2s2 2p6 3s2 3p6 4s2 3d 10 4p6 5s2 4d10 5p6
Il diagramma riportato riassume la regola della diagonale:
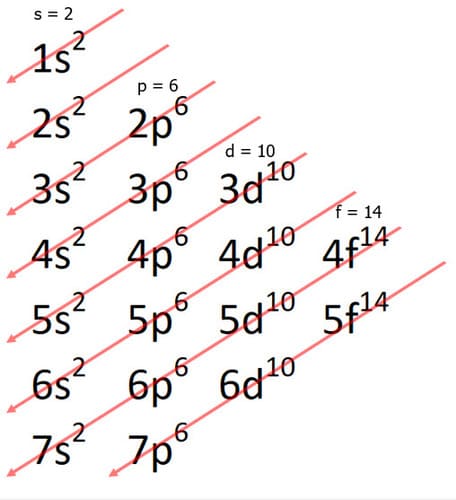
seguendo la freccia si trovano gli orbitali a energia crescente che, mano a mano, sono riempiti secondo il numero degli elettroni dell’elemento



