Il modello atomico di Rutherford o modello planetario
Il modello atomico di Rutherford detto modello planetario fu pubblicato nel 1911 a seguito degli studi del chimico e fisico neozelandese naturalizzato britannico, premio Nobel per la Chimica nel 1908 e pioniere della fisica nucleare. Le ricerche di Rutherford andavano in una direzione diversa da quelle di Thomson che nel 1904 aveva ipotizzato il modello atomico cosiddetto a panettone.
Lo studio delle interazioni tra radiazioni e atomo
Già nel 1902 Rutherford riteneva che i fenomeni radioattivi potessero essere un mezzo per avere informazioni sulla struttura atomica. Pertanto rivolse i suoi studi alle interazioni tra le radiazioni emesse da elementi radioattivi e gli atomi.
Egli studiò i comportamenti di particelle-proiettili fornite da sostanze radioattive quando urtavano sottili fogli metallici rilevando lo scattering ovvero la diffusione o la deviazione angolare della traiettoria di una particella carica in seguito a un urto contro un’altra particella.
Tra il 1906 e il 1911 i due fisici Hans Geiger e Ernest Marsden sotto la direzione di Rutherford effettuarono una serie di esperienze di scattering utilizzando quali proiettili le particelle α costituite da due protoni e due neutroni ovvero di nuclei di elio aventi carica positiva 4He2+.
Esperimento di Rutherford
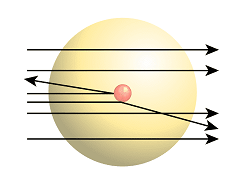
L’esperimento detto di Rutherford ma condotto da Geiger e Marsden consistette nel far colpire da parte di un fascio di particelle α emesso da un campione radioattivo una sottilissima lamina di oro. Dopo l’urto la distribuzione angolare delle particelle α si otteneva contando le scintillazioni prodotte da esse su uno schermo di solfuro di zinco.
Il modello atomico di Rutherford detto modello planetario fu pubblicato nel 1911 a seguito degli studi del chimico e fisico neozelandese naturalizzato britannico, premio Nobel per la Chimica nel 1908 e pioniere della fisica nucleare. Le ricerche di Rutherford andavano in una direzione diversa da quelle di Thomson che nel 1904 aveva ipotizzato il modello atomico cosiddetto a panettone.
Lo studio delle interazioni tra radiazioni e atomo
Già nel 1902 Rutherford riteneva che i fenomeni radioattivi potessero essere un mezzo per avere informazioni sulla struttura atomica e pertanto rivolse i suoi studi alle interazioni tra le radiazioni emesse da elementi radioattivi e gli atomi.
Egli studiò i comportamenti di particelle-proiettili fornite da sostanze radioattive quando urtavano sottili fogli metallici. Rilevò lo scattering ovvero la diffusione o la deviazione angolare della traiettoria di una particella carica in seguito a un urto contro un’altra particella.
Tra il 1906 e il 1911 i due fisici Hans Geiger e Ernest Marsden sotto la direzione di Rutherford effettuarono una serie di esperienze di scattering. Utilizzarono come proiettili le particelle α costituite da due protoni e due neutroni ovvero di nuclei di elio aventi carica positiva 4He2+.
Dall’esperimento al modello atomico di Rutherford
L’esperimento detto di Rutherford ma condotto da Geiger e Marsden consistette nel far colpire da parte di un fascio di particelle α emesso da un campione radioattivo una sottilissima lamina di oro. Dopo l’urto la distribuzione angolare delle particelle α si otteneva contando le scintillazioni prodotte da esse su uno schermo di solfuro di zinco. I risultati ottenuti dall’esperimento furono i seguenti:
- la maggior parte delle particelle attraversava la lamina di oro senza alcuna deviazione o era deviata di angoli relativamente piccoli
- alcune particelle erano deviate di angoli più o meno grandi
- poche particelle rimbalzavano indietro fino a 180° rispetto alla direzione di incidenza
Rutherford conosceva sia la carica che la massa delle particelle α e pertanto la loro energia cinetica. Si rese conto che per produrre una deviazione di un angolo elevato l’atomo doveva essere dotato di una elevata forza elettrica che doveva essere esercitata da un corpo di massa notevole concentrata in una regione molto limitata avente carica positiva racchiusa in un piccolo nocciolo in seguito chiamato nucleo.
L’atomo doveva avere una struttura non uniforme e pertanto il modello di atomo “pieno” e omogeneo proposto da Thomson doveva essere accantonato. Pertanto si impose il modello atomico nucleare proposto da Rutherford detto anche modello atomico planetario secondo cui:
- l’atomo è costituito da un nucleo centrale di dimensioni notevolmente più piccole del diametro dell’atomo dove è concentrata la carica positiva e la massa
- gli elettroni che occupano lo spazio vuoto intorno al nucleo sono carichi negativamente e ruotano intorno al nucleo come i pianeti intorno al Sole
- il numero di elettroni è tale da bilanciare la carica positiva del nucleo.
Il modello atomico di Rutherford sarà successivamente superato. Tuttavia l’ipotesi che il nucleo dell’atomo rappresentasse l’intera massa atomica e che gli elettroni garantissero l’elettroneutralità dell’atomo non è mai stata smentita.


