Cloruro di cesio: sintesi, reazioni, reticolo cristallino, usi
Il cloruro di cesio è un solido cristallino molto solubile in acqua e igroscopico avente formula CsCl utilizzato come fonte di ioni cesio per numerose applicazioni.
Come gli altri alogenuri alcalini il cloruro di cesio è incolore se è presente sotto forma di grossi cristalli e quando è polverizzato si presenta di colore bianco.
I metalli alcalini, infatti, hanno un solo elettrone di valenza e formano ioni positivi i quali non hanno elettroni spaiati. Essi possono subire una promozione da un livello a un altro come avviene nel caso degli ioni dei metalli di transizione che formano composti colorati.
Sintesi
Il cloruro di cesio può essere sintetizzato dalla reazione di neutralizzazione tra acido cloridrico e idrossido di cesio:
HCl(aq) + CsOH(aq) → CsCl(aq) + H2O(l)
Un altro metodo di sintesi consiste nella reazione tra carbonato di cesio e acido cloridrico:
Cs2CO3(aq) + 2 HCl(aq)→ 2 CsCl(aq) + H2O(l) + CO2(aq)
A livello industriale è ottenuto dalla pollucite, minerale appartenente alla famiglia delle zeoliti, che polverizzata è trattata con acido cloridrico a caldo.
Reazioni
Il cloruro di cesio impuro è fatto reagire con cloruro di antimonio (III) con ottenimento di un sale doppio scarsamente solubile in acqua:
CsCl + SbCl3 → CsSbCl4
Quest’ultimo è fatto reagire con solfuro di idrogeno secondo la reazione:
2 CsSbCl4 + 3 H2S → 2 CsCl + Sb2S3+ 6 HCl
Dà luogo alla formazione di sali doppi in particolare con altri cloruri come, ad esempio, 2CsCl·BaCl2
Reticolo cristallino del cloruro di cesio
È un solido ionico in cui ioni positivi e ioni negativi si trovano sui nodi del reticolo cristallino. Il cloruro di sodio che cristallizza secondo un reticolo cubico a facce centrate in cui ogni ione positivo è contornato da 6 ioni negativi e viceversa. Il cloruro di cesio invece cristallizza secondo un reticolo cubico in cui ogni ione positivo è contornato da 8 ioni negativi e viceversa.
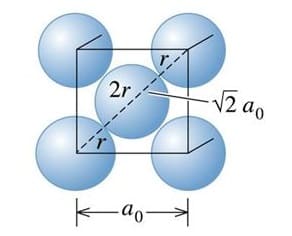
La motivazione per la quale il cloruro di sodio e il cloruro di cesio cristallizzano secondo due reticoli diversi risiede nella dimensione degli ioni.
Supponiamo, infatti, di sostituire il cesio con il sodio nel reticolo del cloruro di cesio. Lo ione sodio è molto più piccolo rispetto allo ione cesio e, affinché gli ioni cloro possano essere in contatto con lo ione sodio nel reticolo, dovrebbero essi stessi trovarsi a contatto tra loro il che provocherebbe l’insorgere di forze di repulsione.
La struttura cristallina in un composto ionico in cui gli ioni si trovano in rapporto di 1:1 dipende dal rapporto tra il raggio dello ione positivo rispetto a quello dello ione negativo.
Se il raggio dello ione positivo è maggiore del 73% rispetto a quello dello ione negativo si ha un numero di coordinazione pari a 8. Se il raggio dello ione positivo è al di sotto del 41% rispetto a quello dello ione negativo si ha un reticolo in cui il numero di coordinazione è pari a 6.
Nel cloruro di cesio lo ione cesio ha un raggio ionico del 93% circa maggiore rispetto a quello dello ione cloruro pertanto si ha un numero di coordinazione pari a 8 compatibile con un reticolo cubico a corpo centrato.
Nel cloruro di sodio il raggio ionico dello ione sodio è solo il 52% rispetto al raggio dello ione cloruro con conseguente numero di coordinazione 6 il che implica un reticolo cubico.
Usi
Il cloruro di cesio è usato per ottenere il cesio metallico per riduzione con il magnesio ad alta temperatura:
2 CsCl + Mg → 2 Cs + MgCl2
È utilizzato per la separazione del DNA a diverse densità tramite la tecnica della centrifugazione differenziale che sfrutta la diversa velocità di sedimentazione di particelle di differente densità e dimensioni mediante tappe di centrifugazione successive aumentando gradualmente il campo centrifugo applicato.
Il cloruro di cesio in cui il cesio si trova come 137Cs e come 131Cs è utilizzato in medicina nucleare.



