Transizioni di fase.
Le transizioni di fase sono probabilmente uno dei fenomeni più interessanti e concettualmente più ricchi affrontati dalla termodinamica e dalla meccanica statistica. Secondo la I.U.P.A.C. le transizioni di fase sono cambiamenti nella natura di una fase o nel numero di fasi come risultato di alcune variazioni di condizioni imposte dall’esterno, come temperatura, pressione, attività di un componente o un campo magnetico o elettrico.
Nella chimica dello stato solido le transizioni di fase portano comunemente all’emergere di proprietà importanti come la superconduttività o la ferroelettricità, o ad un cambiamento nell’ordine magnetico o cristallografico.
La teoria classica delle transizioni di fase caratterizza termodinamicamente i passaggi di stato definendo le variazioni subite dalle funzioni di stato termodinamiche nella transizione di fase: energia interna U, entropia S e conseguenti potenziali termodinamici ovvero l’energia libera di Gibbs ( in onore dello scienziato statunitense Josiah Willard Gibbs) e l’energia libera di Helmholtz.
Classificazione delle transizioni di fase
Le transizioni di fase possono essere classificate in discontinue e continue. Alcune grandezze termodinamiche infatti mostrano discontinuità. Ad esempio l’entropia della fase liquida e quella della fase gassosa sono molto diverse nell’evaporazione a seconda se avviene a pressione o a temperatura costante e ciò si traduce in una discontinuità dell’entropia alla temperatura Tf di evaporazione.
La differenza di entropia Sgas – Sliquido corrisponde a una quantità di calore ∆Q = Tf (Sgas – Sliquido) che deve essere apportato al sistema affinché avvenga l’evaporazione. Questo calore non ha effetto sulla temperatura ma tale energia serve a incrementare l’entropia dal valore Sgas al valore Sliquido. La variazione di entropia corrisponde al calore latente L = T ∆S.
Le transizioni di fase continue implicano un cambiamento continuo nell’entropia, il che significa che non c’è calore latente. Esempi sono le transizioni liquido-gas a temperature superiori a quella critica, transizioni metallo-superconduttore e molte transizioni di ordinamento magnetico.
Ordine di transizione
Le transizioni di fase sono suddivise in due principali categorie: transizioni del primo ordine e transizioni del secondo ordine. Le transizioni di fase del primo ordine presentano un calore latente diverso da zero. Le transizioni di fase del primo ordine quindi sono quelle che coinvolgono un calore latente: al punto della transizione il sistema assorbe o rilascia energia pur mantenendo la temperatura costante.

Quindi le transizioni che sono collegate alla discontinuità dell’entropia appartengono a tale categoria così come le transizioni solido-liquido o liquido-gas. Per questo tipo di transizione, a pressione e a temperatura costante le derivate prime dell’energia libera mostrano discontinuità:
(δG/ δT)p = – S e (δG/ δp)T = V
L’altro tipo di transizione di fase è una transizione di fase del secondo ordine che non ha alcun calore latente ad essa associato come, ad esempio, la transizione di fase da paramagnetica a ferromagnetica. Le transizioni di fase del secondo ordine, che sono esempi di transizioni continue, presentano discontinuità nelle derivate seconde dell’energia libera a pressione e a temperatura costante:
(δ2G/ δT2)p = – cp/T e (δ2G/ δp2)T = – VkT
Sebbene tale classificazione sia stata originariamente formulata per un sistema caratterizzato dalle variabili T , p , e dal volume V (di cui solo due sono indipendenti), può essere generalizzata per includere altre variabili come campi elettrici e magnetici o effetti di deformazione.
Diagrammi di fase
La fase di una determinata sostanza dipende dalla pressione e dalla temperatura pertanto, i grafici della pressione rispetto alla temperatura che mostrano la fase in ciascuna regione forniscono informazioni sulle proprietà termiche delle sostanze. Un diagramma che mostra la fase stabile di un sistema per ogni combinazione di variabili macroscopiche è chiamato diagramma di fase.
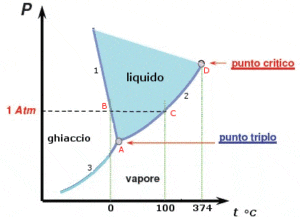
Ad esempio, nel diagramma di fase dell’acqua, i confini della curva continua tra le fasi indicano transizioni di fase. In figura è riportato il diagramma di fase dell’acqua costruito da dati sperimentali pressione-temperatura nei tre stati di aggregazione della sostanza. La curva 1 mostra la variazione della temperatura di fusione del ghiaccio al variare della pressione.
La curva 2 mostra le condizioni di pressione e temperatura in corrispondenza delle quali il liquido si trova in equilibrio con il proprio vapore. La curva 3 mostra le condizioni di pressione e di temperatura in corrispondenza delle quali il solido si trova in equilibrio con il proprio vapore. Il punto A prende il nome di punto triplo in quanto coesistono la fase solida, la fase liquida e la fase gassosa in equilibrio dinamico. Il punto triplo è caratterizzato da un unico valore di temperatura e pressione che per l’acqua sono rispettivamente 0.01 °C e 4.58 mm Hg. In tale punto la tensione di vapore del solido è uguale alla tensione di vapore del liquido.
Dal grafico si può vedere che, alla pressione di 1 atmosfera, all’aumentare della temperatura, avvengono due transizioni di fase rispettivamente a 0 e a 100°C. I diagrammi di fase binari, ovvero in cui sono presenti due componenti, tipicamente utilizzati per le leghe metalliche, la composizione della lega è mostrata sull’asse x e la temperatura della lega è mostrata sull’asse y.
Allotropia e transizioni di fase
L’allotropia è la proprietà di alcuni elementi appartenenti prevalentemente dei Gruppi 13, 14, 15 e 16 della Tavola Periodica che possono presentarsi in forme diverse e differiscono tra loro per le proprietà fisiche e chimiche oltre che per la forma cristallina pur presentando lo stesso stato di aggregazione.

Il carbonio è uno degli elementi più abbondanti sulla terra presente in tutte le molecole organiche che costituiscono il nostro corpo e altri sistemi biologici. Il carbonio, tuttavia, è unico anche in quanto, anche come sostanza elementare, si presenta in forme molto diverse. Il diamante e la grafite sono solo due delle forme allotropiche del carbonio conosciute fin dall’antichità. Durante l’ultimo quarto dello scorso secolo, sono scoperti alcuni nuovi allotropi del carbonio tra cui fullerene, grafene, nanotubi di carbonio.
Considerando il diagramma di fase del carbonio limitato a grafite e diamante oltre alle transizioni di fase solido-liquido, liquido-gas vi sono le transizioni di fase grafite a diamante oltre a quelle tra i diversi stati di aggregazione.

Lo zolfo, elemento del gruppo 16, può presentarsi oltre che solido liquido e gassoso in diverse forme cristalline allotropiche: forma α, rombica stabile fino a 95.5 °C in cui lo zolfo si presenta sotto forma di cristalli con abito bipiramidale e in aggregati granulari e forma β monoclina stabile da 95.5 °C a 119°C ( temperatura di fusione).
Pertanto oltre alle transizioni di fase solido-liquido, liquido-gas vi sono le transizioni di fase dalla forma rombica a quella monoclina e dalla forma monoclina a quella liquida.



