Teorema degli stati corrispondenti: enunciato, Grafico pressione-Volume
Secondo il teorema degli stati corrispondenti alcuni gas reali mostrano un comportamento simile se i parametri sono espressi in termini ridotti
L’equazione di stato di un gas ideale è data dall’espressione p Ṽ = RT dove Ṽ è il volume molare del gas.
Un gas può essere definito ideale se le molecole sono puntiformi e non interagiscono fra loro e con le pareti del recipiente con urti elastici e se non esistono forze di interazione tra le molecole del gas. Nel caso di un gas ideale il fattore di comprimibilità Z = pṼ/RT = 1.
L’equazione del gas ideale vale per tutti i gas a pressioni sufficientemente basse e ciò significa che all’aumentare della pressione agente su una data quantità di gas si osservano deviazioni dal comportamento ideale.
Legge di Boyle
Per un gas ideale a temperatura costante è valida la legge di Boyle per la quale il prodotto tra la pressione e il volume è costante; la rappresentazione grafica della legge di Boyle nel piano p-V è data da un’iperbole equilatera. Se invece consideriamo un gas reale, notiamo che solo per temperature abbastanza alte e pressioni abbastanza basse le isoterme si avvicinano a delle iperboli, in accordo con l’equazione di stato dei gas perfetti.
A determinate condizioni di temperatura e pressione l’attrazione tra le particelle di un gas diventa sufficientemente forte da tenerle unite nella fase liquida: il gas subisce, cioè, un processo di liquefazione. Ciò può avvenire aumentando la pressione che provoca un avvicinamento delle particelle di gas o diminuendo la temperatura infatti le particelle si muovono meno rapidamente e sono maggiormente soggetta le forze di attrazione. Per ogni gas esiste una temperatura detta temperatura critica al disopra della quale esso non può più essere liquefatto, qualunque sia la pressione applicata (gas supercritico). Alla temperatura critica il gas può essere ancora liquefatto alla pressione critica.
La liquefazione di un gas è un processo che non è contemplato nell’equazione ideale dei gas ma può essere spiegato dall’equazione di van der Waals valida per i gas reali.
Grafico pressione-Volume
Essa può essere evidenziata graficamente dalle variazioni sulle curve isoterme che si hanno quando la temperatura caratteristica della curva scende sotto quella critica
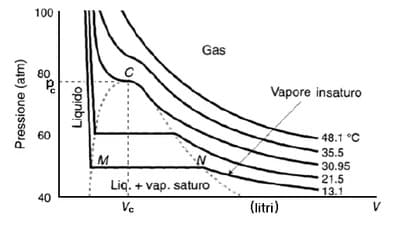
Per i gas reali i valori delle “critiche” diventano delle vere e proprie costanti fisiche caratteristiche di ciascuno di essi, la cui conoscenza riveste notevole importanza sia teorica che pratica. E’ possibile infatti conoscendo i valori sperimentali delle costanti critiche calcolare i valori a e b che compaiono nell’equazione di van der Waals espressa dalla seguente relazione:
[p + n2a/V2)(V-nb) ]= nRT
e confrontarli con quelli desunti da dati di compressibilità traendone conclusioni in relazione all’applicabilità dell’equazione a quel determinato gas. Nell’equazione di van der Waals le costanti a e b sono caratteristiche di ogni gas.
Enunciato del teorema degli stati corrispondenti
Secondo il teorema degli stati corrispondenti ottenuta a partire dall’equazione di van der Waals tutti i gas messi a confronto nelle condizioni corrispondenti, si comportano allo stesso modo purché i parametri siano espressi in termini ridotti. In generale si definisce proprietà termodinamica ridotta il rapporto tra la grandezza assoluta e il valore assunta da essa nel punto critico.
Pertanto la temperatura ridotta è data da Tr = T/Tc, la pressione ridotta è data da pr= p/pc e il volume ridotto è dato da Vr=V/Vc
Dove Tc, pc, e Vc rappresentano rispettivamente la temperatura, la pressione e il volume nel punto critico.
Dall’equazione di van der Waals si può infatti ottenere una relazione tra pr e Vr e Tr indipendente dai valori di a e b:
pr = 8Tr/ 3Vr -1 – 3/Vr2
Tale equazione consente di calcolare le proprietà ridotte di un gas anche se i valori di a e b non sono noti.
Per il teorema degli stati corrispondenti il fattore di comprimibilità ZA di una sostanza A può essere determinato conoscendo il fattore di comprimibilità ZR di una sostanza di riferimento R di cui è noto il comportamento.



