Titolazioni con EDTA: durezza dell’acqua, calcoli
Le titolazioni con EDTA sono titolazioni complessometriche con cui sono determinati alcuni ioni metallici.
L’ EDTA ovvero l’acido etilendiamminotetracetico, sintetizzato per la prima volta dal chimico austriaco Ferdinand Münz, è un acido poliammino carbossilico solubile in acqua dotato di due doppietti elettronici appartenenti all’azoto. La sua base coniugata è l’etilendiamminotetracetato. E’ un agente chelante esadentato ovvero ha la capacità di “sequestrare” ioni metallici quali Ca2+, Mg2+ e Fe3+.
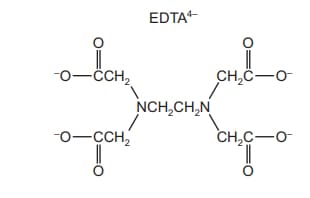
l’etilendiamminotetracetato di sodio forma quattro legami di coordinazione con cationi metallici a valori di pH ≤ 12.
Nelle titolazioni con EDTA si utilizzano indicatori metallocromici costituiti da composti organici che formano complessi stabili con alcuni ioni metallici. Gli indicatori metallocromici devono pertanto avere i seguenti requisiti:
- formare complessi con l’analita
- avere una costante di formazione minore con l’analita rispetto a quella tra analita e titolante
- avere una differente colorazione quando sono presenti nella forma libera e nella loro forma complessata
- presentare selettività

È necessario inoltre che la reazione di complessazione tra indicatore e analita deve essere rapidamente reversibile. La durezza totale di un’acqua viene determinata tramite titolazioni con EDTA titolando un’aliquota di acqua con una soluzione standardizzata di EDTA usando l’indicatore Nero eriocromo T.
La soluzione assumerà una colorazione viola ciclamino. Titolando il campione con l’EDTA, i cationi in soluzione si complessano preferenzialmente con quest’ultimo, fino a giungere al punto di equivalenza oltre il quale la soluzione passa da una colorazione viola-rossa ad una blu scuro.
Durezza totale di un’acqua
La durezza totale di un’acqua viene determinata titolando un’aliquota di acqua con una soluzione standardizzata di EDTA . La reazione che avviene è la seguente:
H2EDTA2- + Ca2+ ⇌ CaEDTA2- + 2 H+
Lo ione complesso CaEDTA2- è molto stabile a pH = 10 e a questo valore la titolazione procede fino a completezza. Le titolazioni complessometriche che utilizzano l’EDTA sono effettuate, tra l’altro, per la determinazione della durezza di un’acqua tramite determinazione quantitativa dello ione Ca2+ e Mg2+.
Per convenzione la durezza di un’acqua è espressa in ppm di carbonato di calcio, ignorando il contributo dovuto ai sali di magnesio.
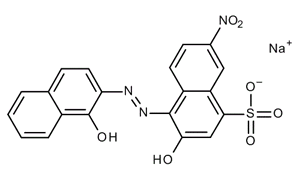
Dato che la massa molecolare di CaCO3 è pari a circa 100 g/mol una durezza di 1000 ppm corrisponde ad una concentrazione totale di calcio e magnesio di 0.01 M. Nella titolazione il punto finale viene evidenziato con un indicatore metallocromico che sia un chelante contenente un gruppo cromoforo ad elevata selettività. L’indicatore più usato per tale tipo di titolazione è il Nero eriocromo T che contiene il cromoforo azo-.
Per effettuare tale titolazione si deve preparare una soluzione standard di EDTA infatti i prodotti in commercio non sono abbastanza puri per essere usati come standard primari. Il composto che viene usato per scopi analitici è il sale disodico di formula Na2H2EDTA∙ 2 H2O. La soluzione viene tamponata a pH 10 usando il tampone idrossido di ammonio/ammoniaca.
Procedura nelle titolazioni con EDTA
25.00 mL di acqua sono addizionati a 25 mL di acqua distillata e si aggiungono 5 mL della soluzione tamponata a pH = 10. Si aggiungono poche gocce di indicatore e si titola con EDTA 0.05 M fin quando la colorazione vira dal rosso al blu.
Calcoli
supponiamo che 50.00 mL di una soluzione richiedano 25.55 mL di una soluzione di EDTA 0.0149 M. Per calcolare la concentrazione dello ione Ca2+ in termini di ppm di CaCO3 si procede con i seguenti calcoli:
0.0149 mol EDTA/L ∙ 0.02555 L ( 1 mol EDTA/ 1 mol Ca2+) = 0.000381 mol Ca2+
0.000381 mol Ca2+ ( 1 mol CaCO3/ 1 mol Ca2+) ( 100.09 g CaCO3/ 1 mol CaCO3) = 0.0381 g CaCO3
ppm CaCO3 = mg CaCO3/ L (soluzione) = 38.1 mg/ 0.02500 L = 762



