Diagrammi ladder per equilibri di acidi deboli
I diagrammi ladder costituiscono uno strumento per poter visualizzare in modo semplice le specie prevalenti a un determinato pH in un equilibrio acido-base.
Consideriamo l’acido debole HA che si dissocia in soluzione acquosa secondo l’equilibrio:
HA(aq) + H2O(l) ⇄ H3O+(aq) + A–(aq)
L’espressione della costante relativa a questo equilibrio è:
Ka = [H3O+][A–] / [HA]
Passando ai logaritmi e moltiplicando ambo i membri per -1 si ha:
– Ka = – log [H3O+] – log [A–] / [HA]
E per definizione otteniamo:
pKa = pH – log [A–]/[HA]
moltiplicando per -1 si ha:
– pKa = – pH + log [A–]/[HA]
Da cui:
pH = pKa + log [A–]/[HA]
che rappresenta, peraltro, l’equazione di Henderson-Hasselbalch dovuta ai chimici Lawrence Joseph Henderson e Karl Albert Hasselbalch.
Se le concentrazioni di A– e HA sono uguali si ha:
pH = pKa + log 1 = pKa
Se la concentrazione di A– è maggiore rispetto alla concentrazione di HA allora [A–]/[HA] > 1 e quindi si ha: pH > pKa
Se la concentrazione di A– è minore rispetto alla concentrazione di HA allora [A–]/[HA] < 1 e quindi si ha: pH< pKa
Costruzione dei diagrammi ladder
Il valore di pKa di HF è pari a 3.2 e si possono verificare tre casi:
1) [F–] = [HF]
Allora pH = pKa = 3.2
2) [F–] > [HF]
Supponiamo che [F–] = 0.10 M e [HF] = 0.080 M
Si ha: pH = pKa + log [F–]/[HF] = 3.2 + log 0.10/0.080 = 3.3
e quindi pH > pKa
3) [F–] < [HF]
Supponiamo che [F–] = 0.080 M e [HF] = 0.10 M
Si ha: pH = pKa + log [F–]/[HF] = 3.2 + log 0.080/0.10 = 3.1
e quindi pH < pKa
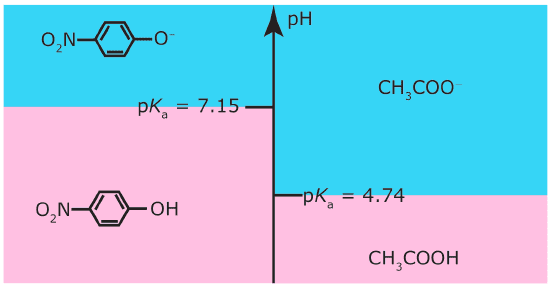
La deduzione che può essere fatta è che il valore del pKa gioca un ruolo fondamentale: se il pH è maggiore del valore di pKa allora la specie prevalente è la base coniugata A– mentre se il pH è minore del valore di pKa allora la specie prevalente è l’acido debole HA.
Possiamo costruire allora un diagramma ladder per l’acido in esame. Per prima cosa si traccia una linea verticale con la freccia rivolta verso l’alto ↑ dove viene rappresentato il pH della soluzione: in basso vi sono bassi valori di pH corrispondenti ad una maggiore acidità e in alto alti valori di pH corrispondenti ad una maggiore basicità.
Si traccia poi una linea orizzontale al valore di pH corrispondente al pKa: questa linea divide l’asse del pH in due regioni. Una regione, in alto, corrisponde a valori di pH > pKa quindi la specie prevalente è la base coniugata A– mentre l’altra regione, in basso corrisponde a valori di pH < pKa in cui la specie prevalente è l’acido. Se si verifica che pH = pKa allora si ha che [A–] = [HA].
Nel caso dell’acido acetico il cui pH è pari a 4.76 il diagramma ladder si presenta come in figura:
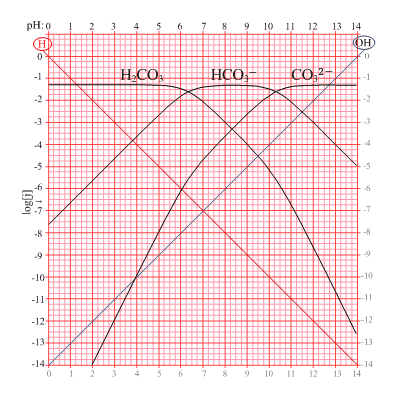
Nel caso di un acido diprotico come l’acido carbonico si hanno due reazioni di dissociazione:
H2CO3(aq) + H2O(l) ⇄ H3O+(aq) + HCO3–(aq)
HCO3–(aq) + H2O(l) ⇄ H3O+(aq) + CO32-(aq)
Tali equilibri sono regolati rispettivamente da una Ka1 e da una Ka2 e, con ragionamento analogo al precedente si ha che per valori di pH < Ka1 la specie prevalente è l’acido indissociato; per pH = Ka1 si verifica che [H2CO3] = [HCO3–]
Se i valori di pH sono compresi tra pKa1 e pKa2 la specie prevalente è HCO3–.
Per pH = pKa2 si verifica che [HCO3–]= [CO32-]
Per valori di pH > pKa2 si ha che la specie predominante è CO32- come si può vedere dalla figura:
Diagrammi ladder per equilibri di complessazione
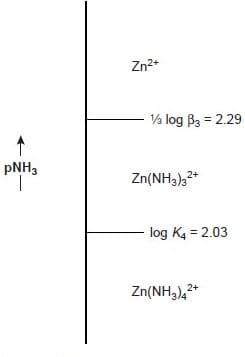
Gli stessi principi utilizzati nella costruzione e interpretazione dei diagrammi ladder per gli equilibri acido-base possono essere applicati agli equilibri che coinvolgono complessi metallo-legante.
Per le reazioni di complessazione la scala del diagramma ladder è definita dalla concentrazione del legante non complessato o libero, pL.
In figura è rappresentato un diagramma ladder per Zn2+, Zn(NH3)32+ e Zn(NH3)42+
Usando come esempio la formazione del complesso diamminocadmio Cd(NH3)2+
Si può dimostrare dimostrare che la linea di demarcazione tra le regioni di predominanza di Cd 2+ e Cd(NH3)2+ è log(K1).
Poiché K 1 per Cd(NH3)2+ è 3.55 · 102 , log(K1) è 2.55. Pertanto, per un valore di pNH3 maggiore di 2.55 corrispondente a concentrazioni di ammoniaca inferiori a 2.8 · 10–3 M, la specie predominante è Cd2+.



