Glicolisi: ossidazione del glucosio, fasi
La glicolisi comporta l’ossidazione glucosio che è una reazione spontanea in quanto la variazione dell’energia libera di Gibbs è minore di zero. Il processo della glicolisi è stato studiato per oltre 100 anni e fu solo nel 1920 che medico e biochimico tedesco Otto Fritz Meyerhof, vincitore del Premio Nobel per la Medicina nel 1922, avvalendosi delle precedenti ricerche riuscì a collegare insieme alcuni dei tanti singoli pezzi della glicolisi scoperti dai precedenti scienziati.
Il glucosio costituisce la maggiore fonte energetica degli organismi viventi: quando il glucosio è ossidato nel processo metabolico i prodotti di reazione sono biossido di carbonio e acqua oltre all’energia che viene usata dalle cellule.
Il Sole emette luce che è tratta dalle piante le quali attraverso il processo fotosintetico convertono il biossido di carbonio e l’acqua in glucosio secondo la reazione:
6 CO2 + 6 H2O → C6H12O6 + 6 O2
La variazione di energia libera ΔG correlata a tale reazione, infatti è di + 2870 kJ/mol e pertanto, affinché essa possa avvenire è necessaria una fonte energetica che è appunto costituita dalla luce.
Gli organismi eterotrofi non sono in grado di sintetizzare autonomamente le molecole organiche da molecole inorganiche e quindi devono far riferimento a composti organici precedentemente sintetizzati da organismi autotrofi quali le piante traendo energia da reazioni chimiche che avvengono secondo il verso opposto rispetto a quello che avviene nelle piante ovvero degradando il glucosio in biossido di carbonio e acqua.
La reazione di ossidazione del glucosio presenta una variazione di energia libera di – 2870 kJ/mol e quindi è una reazione spontanea.
L’energia tratta è molto alta e non può essere spesa in un unico stadio e deve essere frazionata in unità più piccole.
Consideriamo una tipica reazione biochimica catalizzata dall’enzima fosfoglucocumutasi:
glucosio-1-fosfato ⇄ glucosio-6-fosfato
Supponiamo di avere una soluzione di glucosio-1-fosfato a concentrazione fisiologica 0.02 M e, dopo che la reazione ha avuto luogo, si ha all’equilibrio che la concentrazione di glucosio-1-fosfato è 0.001 M mentre quella di glucosio-6-fosfato è 0.019 M.
Possiamo quindi calcolare la costante di equilibrio K relativa a tale reazione:
K = [glucosio-6-fosfato]/[ glucosio-1-fosfato] = 0.019 / 0.001 = 19
E conseguentemente la variazione di energia libera:
ΔG = – RT ln K = – 2.203 RT log 19 = – 7.30 kJ/mol
L’ossidazione del glucosio avviene secondo una serie di reazioni in cui sono presenti ATP (adenosintrifosfato, principale trasportatore di energia chimica negli organismi viventi), ADP (adenosindifosfato) che si forma dalla reazione:
ATP + H2O → ADP + Pi che ha un ΔG° = – 30.54 kJ/mol
NAD+ (nicotinamide adenina dinucleotide) e NADH ( forma ridotta di NAD+).
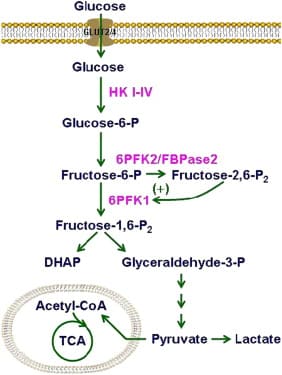
Stadi della glicolisi
La prima reazione della glicolisi, in cui ΔG° = – 196.6 kJ/mol, è:
C6H12O6 + 2 ATP + 2 ADP + 2 NAD+ → 2 NADH + 4 ATP + 2 acido lattico
Pertanto dalla glicolisi di una molecola di glucosio si ottengono 2 molecole di ATP e 2 molecole di acido lattico il cui nome sistematico è acido 2-idrossipropanoico CH3CH(OH)COOH .
L’ NADH prodotto nella reazione reagisce a sua volta col l’ATP secondo la reazione:
2[ 3 ADP + NADH → NAD+ + 3 ATP]
In tale reazione si ha la perdita di 2 molecole di NADH e di 6 molecole di ATP e formazione di 2 molecole di NAD+ e di 6 molecole di ATP.
Complessivamente nei due stadi considerati si ha il consumo di una molecola di glucosio e di 8 molecole di ADP. Si verifica la formazione di 8 molecole di ATP e 2 molecole di acido lattico.
Ciclo di Krebs
Il terzo stadio, detto ciclo di Krebs, procede secondo la reazione:
2[CH3CH(OH)COOH + 6 O2+ 15 ADP → 3 CO2 + 3 H2O+ 15 ATP]
In questo stadio 2 molecole di acido lattico vengono trasformate in 6 molecole di biossido di carbonio e 6 molecole di acqua e 30 molecole di ADP vengono trasformate in 30 molecole di ATP.
La reazione complessiva di ossidazione del glucosio è pertanto:
6 O2+ C6H12O6 + 38 ADP → 38 ATP + 6 CO2 + 6 H2O
L’energia complessiva della reazione
6 O2 + C6H12O6 → 6 CO2 + 6 H2O è di – 2870 kJ/mol
mentre l’energia necessaria per la reazione
38 ADP → 38 ATP
è pari a 38( + 30.54) = + 1160.5 kJ/mol
Il rendimento della reazione è pari a 1160.5 ∙ 100/ 2870 = 40.4 % in condizioni standard. In condizioni biologiche il rendimento oscilla tra il 44 e il 66%.