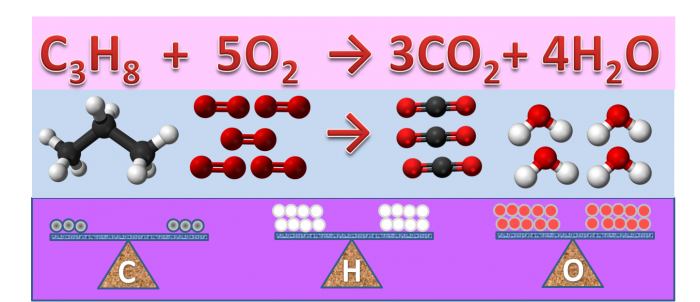
Bilanciamento “a vista” di una reazione
Il bilanciamento di una reazione serve a fare in modo che nei reagenti e nei prodotti siano presenti lo stesso numero di elementi. Il coefficiente stechiometrico è il numero che viene anteposto alle varie specie presenti per fare in modo che la stessa quantità di ogni elemento compaia da ambo i membri della reazione.
I coefficienti stechiometrici rappresentano il numero più piccolo che consente di bilanciare una reazione ed in genere vengono espressi con numeri interi e vengono utilizzati per determinare il rapporto tra le moli delle singole specie presenti.
Metodi di bilanciamento
Molte reazioni sono di ossidoriduzione e il loro bilanciamento può avvenire secondo il metodo del numero di ossidazione o secondo il metodo delle semireazioni. Tuttavia molte di queste reazioni possono essere agevolmente bilanciate “a vista” senza dover ricorrere ai metodi menzionati.
Consideriamo, ad esempio, la reazione di scambio semplice:
Na + HCl → NaCl + H2
per poter bilanciare, dato che a destra compaiono due atomi di idrogeno, bisogna anteporre ad HCl il coefficiente 2; così, essendo presenti a sinistra due atomi di cloro è necessario mettere il coefficiente 2 davanti a NaCl. Poiché a destra vi sono 2 atomi di Na si antepone al sodio, presente a sinistra il coefficiente 2. La reazione così bilanciata è:
2 Na +2 HCl →2 NaCl + H2
Ciò implica che 2 moli di Na reagiscono con 2 moli di HCl per dare 2 moli di NaCl e 1 mole di H2. La reazione bilanciata tramite i coefficienti stechiometrici rende possibile utilizzare i dati relativi a un reagente per ottenere dati quantitativi relativi agli altri reagenti e ai prodotti di reazione.
A volte la stessa reazione può essere presentata utilizzando coefficienti frazionari ottenuti dividendo per 2 tutti i coefficienti della precedente equazione ovvero:
Na + HCl → NaCl + ½ H2
Costruzione di una tabella
Consideriamo la seguente reazione di combustione:
C2H6 + O2 → CO2 + H2O
Per bilanciarla contiamo il numero di atomi di ciascun elemento:
| Elemento | Numero di atomi nei reagenti | Numero di atomi nei prodotti |
| C | 2 | 1 |
| H | 6 | 2 |
O | 2 | 3 |
Anteponiamo il coefficiente stechiometrico 2 davanti a CO2 per bilanciare il carbonio
C2H6 + O2 → 2 CO2 + H2O
| Elemento | Numero di atomi nei reagenti | Numero di atomi nei prodotti |
| C | 2 | 2 |
| H | 6 | 2 |
| O | 2 | 5 |
Anteponiamo il coefficiente stechiometrico davanti ad H2O per bilanciare l’idrogeno:
C2H6 + O2 → 2 CO2 + 3 H2O
| Elemento | Numero di atomi nei reagenti | Numero di atomi nei prodotti |
| C | 2 | 2 |
| H | 6 | 6 |
| O | 2 | 7 |
A questo punto rimane da bilanciare l’ossigeno cosa che può essere fatta rapidamente anteponendo il coefficiente stechiometrico 7/2 davanti a O2:
C2H6 + 7/2 O2 → 2 CO2 +3 H2O
Volendo scrivere la reazione bilanciata con coefficienti interi moltiplichiamo ciascun coefficiente per 2:
2 C2H6 +7 O2 → 4 CO2 + 6 H2O
Ciò implica che 2 moli di C2H6 reagiscono con 7 moli di O2 per dare 4 moli di CO2 e 6 moli di H2O
Questo metodo presenta notevoli vantaggi e, quando si acquista una certa pratica, non è necessaria la costruzione della tabella