Energia in un sistema biatomico
A distanza infinita l’energia di un sistema biatomico è la somma delle energie dei due atomi non essendo presente alcuna forza che possa agire a distanza infinita.
Si consideri come varia l’energia del sistema quando i due atomi passano da distanze infinite a distanze finite, ovvero quando i due atomi interagiranno tra loro.
All’energia potenziale del sistema biatomico contribuiranno:
- le attrazioni di tipo elettrostatico tra i due nuclei positivi e gli elettroni negativi
- le repulsioni tra le due nuvole elettroniche e i due nuclei.
Oltre che i contributi dell’energia potenziale si deve tenere conto anche dell’energia cinetica degli elettroni e dei nuclei che variano rispetto al caso di atomi isolati.
La massa dei nuclei M è molto maggiore rispetto alla massa degli elettroni m essendo il rapporto M/m pari a circa 2000: i nuclei si muovono quindi molto più lentamente degli elettroni cosicché si può considerare che un elettrone veda in ogni istante i nuclei come fissi; l’energia totale del sistema è, di conseguenza, poco influenzata dal lento moto dei nuclei. In prima approssimazione si può, quindi, trascurare il contributo dell’energia cinetica dei nuclei. Si può quindi esprimere l’energia del sistema A-A in funzione della distanza tra i due nuclei stessi.
Nello schema descritto l’energia del sistema biatomico è data dall’energia degli elettroni nel campo di potenziale creato dai nuclei fissi. Ad essa va sommata l’energia di repulsione tra i nuclei.
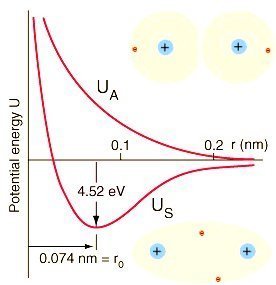
Nella figura
è riportato un diagramma costruito secondo i principi illustrati.
Curva US
La curva US rappresenta il caso in cui l’interazione tra gli atomi porta ad un aggregato stabile. Può essere suddivisa in tre zone: la prima, corrispondente alle grandi distanza, caratterizzata da interazioni deboli.
La seconda, corrispondente alla distanza di legame e la terza corrispondente alle brevi distanze internucleari alle quali si sviluppano forti interazioni repulsive.
Nella prima regione prevalgono deboli forze attrattive e l’energia del sistema si abbassa rispetto alla situazione in cui gli atomi non interagiscono affatto.
Nella seconda regione il contributo maggiore è dato dalle forze attrattive nucleo-elettrone. Il valore di energia per il sistema è molto più basso rispetto a quello che si ha a distanze infinite. Infine, nella terza regione, il contributo più importante all’energia è quello delle forze repulsive nucleo-nucleo ed elettrone-elettrone e l’energia del sistema sale rapidamente. A distanza nulla ( r = 0) l’energia del sistema è molto più alta di quella in cui i due nuclei si trovano a distanza infinita.
La curva US mostra un profondo minimo in corrispondenza di un determinata distanza internucleare ro. Questa distanza rappresenta una posizione di equilibrio intorno alla quale i nuclei possono solo oscillare. Se infatti i due nuclei si spostano da tale posizione l’energia del sistema aumenta e si sviluppano quindi le forze che tendono a riportare il sistema alla condizione di minima energia. Le oscillazioni dei nuclei intorno alla posizione di equilibrio vengono dette vibrazioni molecolari che, tuttavia, contribuiscono in maniera trascurabile all’energia totale del sistema.
Curva UA
La curva UA illustra, invece, una situazione diversa per la quale l’energia del sistema è sempre maggiore di quella degli atomi separati: in questo caso l’energia attrattiva è così piccola da essere superata, anche alle grandi distanze, da quella repulsiva.
Se, quindi, nell’ideale processo di avvicinamento tra i due atomi l’energia è descritta dalla curva US si ha formazione di un aggregato stabile A2. Il processo di formazione della molecola è accompagnato da un guadagno energetico corrispondente a – Do differenza in energia tra il sistema dei due atomi a distanza infinita e l’energia del sistema nella posizione di equilibrio ro. E’ da notare che Do è l’energia che bisogna fornire alla molecola per dissociarsi e quindi Do coincide con l’energia di dissociazione. Se, invece, l’energia del sistema è rappresentata dalla curva UA non si ha formazione di un aggregato stabile perché l’energia del sistema è sempre maggiore dell’energia dei due atomi isolati.
Queste considerazioni sono valide in linea del tutto generale; infatti, se si fossero considerati due atomi diversi A-B il tipo di ragionamento sarebbe stato lo stesso e il tipo di curve e di conclusioni non sarebbero variati di molto. Più complessa è l’estensione ad aggregati atomici costituiti da più atomi. In questo caso l’energia del sistema deve essere messa in relazione con un maggior numero di distanze internucleari: nel caso di un sistema triatomico ABC, per esempio, l’energia del sistema dipende dalle distanze internucleari A-B, A-C, B-C anche se il metodo di procedere e le considerazioni fatte non muterebbero la loro validità anche nel caso più complesso.