Diagramma di fase dell’acqua
Nel diagramma di fase dell’acqua vi sono tre curve che si intersecano in un punto detto punto triplo in cui coesistono i tre stati di aggregazione. Il diagramma di fase dell’acqua è un diagramma pressione-temperatura che mostra l’acqua nei suoi vari stati come ghiaccio, liquido e vapore in diverse condizioni .
In figura è riportato il diagramma di fase dell’acqua costruito da dati sperimentali pressione-temperatura nei tre stati di aggregazione della sostanza:
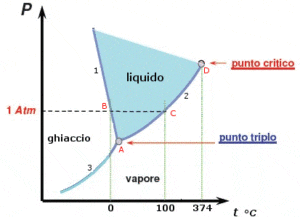
Interpretazione del diagramma di fase dell’acqua
La curva 1 evidenzia le condizioni di pressione e temperatura in corrispondenza delle quali il solido si trova in punto equilibrio con il liquido. La curva mostra la variazione della temperatura di fusione del ghiaccio al variare della pressione. Va evidenziato che nelle maggior parte delle sostanze esibiscono una pendenza positiva della curva, mentre, nel caso dell’acqua si ha una pendenza negativa.
Tale pendenza implica che all’aumentare della pressione la temperatura di fusione dell’acqua si abbassa ed è dovuta al fatto che l’acqua , al contrario della gran parte delle altre sostanze liquide quando congela aumenta di volume.
La curva 2 mostra le condizioni di pressione e temperatura in corrispondenza delle quali il liquido si trova in equilibrio con il proprio vapore.
La curva 3 mostra le condizioni di pressione e di temperatura in corrispondenza delle quali il solido si trova in equilibrio con il proprio vapore.
In relazione alla curva 1 consideriamo le conseguenze termodinamiche della pendenza negativa usando l’equazione di Clapeyron dovuta al fisico e ingegnere francese Émile Clapeyron :
(δp/ δT)ΔG = ΔS/ ΔV (1)
in cui ΔS e ΔV si riferiscono al processo di fusione o di solidificazione. Consideriamo il processo di fusione e quindi consideriamo il passaggio di stato:
H2O(s)→ H2O(l)
Una pendenza negativa della curva nel diagramma di fase indica che la derivata dell’equazione (1) è negativa pertanto:
(δp/ δT)ΔG = ΔS/ ΔV < 0 (2)
Poiché ΔS nel processo di fusione è positivo in quanto il sistema passa dallo stato solido cristallino altamente ordinato allo stato liquido che ha un maggior grado di disordine allora affinché si verifichi che ΔS/ ΔV < 0 deve avvenire che ΔV < 0. Ciò implica che al punto di fusione il volume molare del liquido è minore rispetto al volume molare del solido ovvero Ṽl – Ṽs < 0
Quindi alla temperatura di fusione Ṽl < Ṽs e, passando ai reciproci, si ha:
1/ Ṽl > 1/ Ṽs
e poiché la densità è proporzionale al reciproco del volume ciò implica che la densità del liquido è maggiore rispetto a quella del solido alla temperature di fusione.
Risultati
Questo risultato in qualche modo contrasta con il fatto che la maggior parte delle sostanze, si occupano un volume maggiore quando fondono. L’acqua tuttavia mostra un comportamento anomalo. La conseguenza più palese di tale comportamento può essere osservata quando si vede il ghiaccio galleggiare sull’acqua evento atipico in quanto i solidi tendono ad affondare.
Le implicazioni della pendenza negativa della curva sono notevoli: se la pendenza fosse positiva, infatti, il ghiaccio affonderebbe in acqua e in posti con un clima freddo durante l’inverno si formerebbero depositi di ghiaccio sul fondo. Nel corso delle stagioni più calde solo parte del ghiaccio fonderebbe e con il tempo si verificherebbe un accumulo di ghiaccio di sempre maggiore entità con la conseguenza che i fiumi, i laghi e parte degli oceani, sarebbero in gran parte ghiacciati e la vita animale e vegetale cesserebbe di esistere.
Man mano che ci si avvicina al punto critico, le differenze nelle proprietà fisiche (come densità ed entalpia) tra la fase liquida e quella vapore diventano minori . Ad esempio, al di sotto del punto critico alla pressione di 21.8 MPa e alla temperatura di 373°C, l’entalpia specifica del liquido saturo è 1970 kJ/kg, mentre l’entalpia specifica del vapore saturo è 2230 kJ/kg.



