Acidità di ioni metallici in soluzione
Gli ioni metallici in soluzione acquosa si trovano come acquoioni complessati con molecole di acqua che funge da legante grazie al doppietto elettronico solitario presente sull’ossigeno.
Gli ioni metallici possono coordinare un diverso numero di molecole di acqua a partire da 4 per il berillio (II) fino a 9 per il lantanio (III).
Abitualmente 6 molecole di acqua fungono da leganti per i metalli di transizione e danno soluzioni colorate a causa dell’orbitale d incompleto.
Ad esempio [Fe(H2O)6]2+ è verde, [Cu(H2O)6]2+ è azzurra e [Fe(H2O)6]3+. Gli ioni metallici con bassa densità di carica, come gli ioni dei metalli alcalini più pesanti e il tallio (I), sono debolmente idratati e solvatati e cristallizzano nella maggior parte dei casi senza una prima idratazione completa o un guscio di solvatazione.
Un secondo guscio di idratazione può essere studiato solo in soluzione acquosa, poiché non è stato riportato che nessuno ione metallico idrato cristallizzi con una seconda sfera di idratazione.
Legame e acidità di ioni metallici
La formazione del legame di coordinazione esplica un effetto sugli elettroni di legame tra ossigeno e idrogeno che si avvicinano all’ossigeno; gli atomi di idrogeno assumeranno quindi una parziale carica positiva maggiore rispetto a quella presente in un legame O-H.
Gli atomi di idrogeno risulteranno pertanto sufficientemente positivi e lo ione complesso agisce da acido donando un protone all’acqua
Acidi di Brønsted e Lowry
Questi acquoioni si comportano da acidi secondo Brønsted e Lowry dovuta a Johannes Nicolaus Brønsted e Thomas Martin Lowry in quanto agiscono da donatori di protoni. Ad esempio il complesso esaacquoferro (III)
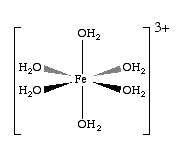
agisce da acido reagendo con l’acqua secondo l’equilibrio:
[Fe(H2O)6]3+ + H2O ⇄ [Fe(OH)5 (OH)]2+ + H3O+
La costante relativa a questo equilibrio vale 8.9 · 10-4 e ciò implica che una soluzione contenente ioni Fe3+ ha un comportamento acido.
Valore della costante di equilibrio
Il valore della Ka è influenzato dai seguenti parametri:
- Dimensioni dello ione metallico
Quanto minore è la dimensione dello ione metallico tanto minore è il valore di pKa e ciò implica, a parità di concentrazione un pH più basso. Si riportano ad esempio i dati relativi agli ioni di metalli alcalino-terrosi:
| Ione metallico | Be2+ | Mg2+ | Ca2+ | Sr2+ | Ba2+ |
| Raggio ionico (Å) | 0.27 | 0.74 | 1.00 | 1.18 | 1.36 |
| pKa | 1.02 | 11.4 | 12.7 | 13.2 | 13.4 |
- Carica dello ione
Quanto maggiore è la carica degli ioni metallici di dimensioni simili tanto minore è il valore di pKa e ciò implica, a parità di concentrazione un pH più basso.
| Ione metallico | Na+ | Ca2+ | La3+ | Th4+ |
| Raggio ionico (Å) | 1.02 | 1.00 | 1.03 | 0.94 |
| pKa | 14.1 | 12.7 | 8.5 | 3.2 |
- Elettronegatività
L’elettronegatività tende a prevalere sui primi due fattori nel controllo dell’acidità degli ioni metallici. Gli ioni metallici con maggiore elettronegatività sono molto più acidi degli ioni metallici di dimensioni e carica simili con bassa elettronegatività



