Processo isotermico: lavoro, grafici, esempi
Un processo isotermico avviene a temperatura costante e per esso vale la legge di Boyle dovuta a Robert Boyle per la quale il prodotto tra pressione e volume è costante:
pV = K
Consideriamo un sistema che passa dallo stato A caratterizzato dalla pressione p1, dal volume V1 e dalla temperatura T, allo stato B caratterizzato dalla pressione p2, dal volume V2 e dalla temperatura T. Dall’ equazione di stato dei gas:
p1V1 = nRT
p2V2 = nRT
da cui p1V1 = p2V2 = nRT
Lavoro in un processo isotermico
In una espansione isoterma reversibile il lavoro w compiuto dal sistema e avente pertanto segno negativo è dato da:
w = – ∫pdV essendo l’integrale definito tra V1 e V2.
In tale processo la pressione non è costante ma varia in funzione del volume. Sappiamo dall’equazione di stato dei gas che p = nRT/V
Sostituendo a p il suo valore nell’integrale si ha:
w = – ∫nRTdV/V essendo l’integrale definito tra V1 e V2
Essendo nRT costanti l’integrale si riduce a:
w = – nRT∫dV/V essendo l’integrale definito tra V1 e V2
Risolvendo l’integrale si ha:
w = – nRT(ln V2-V1) = – nRT ln(V2/V1)
Un processo isotermico può essere rappresentato dal seguente diagramma pV:
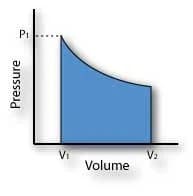
In un processo isotermico la variazione dell’energia interna è pari a zero e pertanto dal Primo principio delle termodinamica: ΔQ = Δw + ΔU si ottiene:
ΔQ = Δw
Il calore fornito durante tale processo viene usato per compiere lavoro contro l’ambiente esterno.
Esempio
Un campione costituito da 2.00 moli di He è fatto espandere isotermicamente alla temperatura di 295 K dal volume di 22.8 dm3 al volume di 31.7 dm3. Calcolare w e q se:
a) La trasformazione avviene in modo reversibile
b) La trasformazione avviene contro una pressione esterna uguale alla pressione finale del gas
Caso a)
Quando la trasformazione avviene in modo reversibile si ha pest = psis
Pertanto w = – nRT ln(V2/V1) = – 2.00 mol ∙ (8.31447 J/mol K)(295 K) ln (31.7 dm3/22.8 dm3)= – 1.62 ∙ 103 J = – 162 kJ
q = – w = + 162 kJ
Caso b)
La pressione finale p2 è pari a:
p2 = nRT/V2 = 2.00 mol ( 0.08206 L atm/mol K) ( 295 K) / 31.7 L = 1.53 atm
poiché 1 atm = 101325 Pa
si ha p2 = 1.55 x 105 Pa
w = – pest ΔV = – 1.55 ∙ 105 ( 31.7 – 22.8) = – 1.38 ∙ 106 J = – 1.38 ∙ 103 kJ
q = – w = + 1.38 ∙ 103 kJ
Per un processo isotermico pV = K
Differenziando l’equazione si ha:
pdV + Vdp = 0
ovvero pdV = – Vdp
da cui
p = – Vdp/dV
Il termine – Vdp/dV viene definito come modulo di compressibilità e misura la resistenza di una specie ad una compressione uniforme



