Atomi polielettronici: energia potenziale, energia di repulsione
Gli atomi polielettronici contengono più di un elettrone e quindi l’atomo di elio costituisce l’esempio più semplice di un atomo polielettronico.
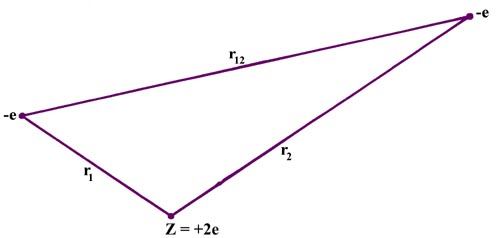
Nel passare dalla descrizione dell’atomo di idrogeno a quella di atomi polielettronici sorgono numerose difficoltà. Per l’atomo di elio dobbiamo infatti considerare tutte le interazioni potenziali che si possono trovare. Per far ciò consideriamo gli elettroni come particelle cariche puntiformi e immaginiamo di fotografarli in un dato istante.
Gli elettroni sono identificati dalla loro carica –e e il nucleo dalla sua carica + 2e.
Energia potenziale media
L’energia potenziale media determinabile da considerazioni quantomeccaniche è:
PE = (+2e)(-e) / r1 + (+2e)(-e) / r2 + (- e)(-e) / r12 = – 2e2/r1 – 2e2/r2 + e2/r12 (1)
Il primo e il secondo termine dell’equazione rappresentano l’attrazione del nucleo di elio nei confronti dell’elettrone 1 e dell’elettrone 2 rispettivamente.
L’ultimo termine rappresenta la repulsione tra i due elettroni la cui determinazione è problematica infatti non esiste alcuna soluzione in quanto dovrebbero essere considerate contemporaneamente troppe interazioni.
Si deve ricorrere pertanto ad alcune approssimazioni. Poiché la carica nucleare è il doppio della carica elettronica, l’energia di repulsione tra gli elettroni deve costituire il più piccolo dei tre termini dell’equazione (1) quindi tale termine può essere trascurato. Se si ha ragione di trascurare la repulsione tra gli elettroni allora si può supporre che gli elettroni non risentano l’uno dell’altro e quindi il problema si può risolvere in modo analogo a quello dell’atomo di idrogeno tenendo, tuttavia conto che la carica nucleare vale +2 anziché +1 come nel caso dell’idrogeno.
L’energia di ciascun elettrone che risente di una carica nucleare +2 è quindi determinata separatamente e l’energia totale è data dalla somma delle due energie. Conoscendo come i due elettroni sono distribuiti l’uno rispetto all’altro possiamo inserire il termine e2/r12 inizialmente trascurato nell’equazione dell’energia potenziale e calcolarne il contributo. Con tale metodo ogni elettrone viene considerato indipendentemente dagli altri.
L’energia di un elettrone è espressa dall’equazione
En = – 2π2me4Z2/ n2h2
Dove m è la massa dell’elettrone, e è il valore della sua carica, n è il numero quantico, h è la costante di Planck e Z il numero atomico corrispondente al numero di cariche positive presenti nel nucleo.
Ponendo K = 2π2me4Z2/h2 si ha:
En = – Z2 K/ n2
Quando ogni elettrone è considerato indipendentemente dagli altri il suo moto e la sua distribuzione nello spazio vengono determinati da un orbitale atomico. La distanza tra nucleo ed elettrone diminuisce quando la carica nucleare e quindi la forza di attrazione esercitata dal nucleo aumenta. Gli orbitali rimangono individuati dai tre numeri quantici n, l e m.
L’aumento di Z ovvero della carica positiva nel nucleo contrae l’orbitale per il quale, tuttavia, sussiste la stessa simmetria. Ci si può quindi riferire agli orbitali 1s, 2s, 2p come per l’atomo di idrogeno. L’orbitale 1s, quello che ha il valore più negativo di E è il più stabile a prescindere dal valore di Z e si assume che la forma più stabile dell’atomo di elio è quella in cui entrambi gli elettroni si trovano nell’orbitale 1s. L’informazione che ci indica in quale orbitale atomico si trovano rispettivamente gli elettroni viene detta configurazione elettronica.
Per l’atomo di elio l’energia dei due elettroni, considerati indipendentemente l’uno dall’altro è data dall’equazione:
E1 = – (22/1) K – (22/1) K = – 8 K
per la configurazione 1s2. A questo valore di energia deve essere aggiunta l’energia di repulsione tra i due elettroni. Poiché entrambi gli elettroni si trovano in un orbitale 1s la distribuzione di carica di ogni elettrone deve essere di tipo sferico.
Energia di repulsione
Le due distribuzioni di carica si mescolano e quindi si deve calcolare l’energia di repulsione tra ogni elemento di densità di carica della prima distribuzione con ogni elemento di densità di carica della seconda distribuzione. Il computo può essere effettuato tramite il calcolo integrale e il valore medio dell’energia di repulsione risulta essere:
Ec = 5 ZK/4
Per l’atomo di elio Z = 2 pertanto Ec = 5 K/2. Tale valore di energia è identificato come la prima approssimazione. L’energia elettronica totale per l’atomo di elio è quindi:
EHe = E1 + Ec = – 8K + 5K/2 = – 11 K/2
Tale energia è detta energia elettronica di legame e, ricordando che –K rappresenta l’energia di legame dello stato più stabile dell’idrogeno, si ha che l’atomo di elio ha una stabilità maggiore di quella dell’idrogeno corrispondente a 11/2. Tuttavia questo non è un confronto equo in quanto il valore 11K/2 è l’energia necessaria per allontanare entrambi gli elettroni dall’atomo di elio:
He → He2+ + 2 e– ΔE = 11 K/2
Appare quindi più interessante confrontare l’energia necessaria per allontanare un unico elettrone da un atomo di elio con quella necessaria per allontanare l’elettrone da un atomo di idrogeno.
Detta I l’energia necessaria per ionizzare un atomo si ha:
He → He+ + e– ΔE = I
In cui
I = EHe+ + Ee– – EHe
Poiché En = – Z2 K/ n2 si ha per He+ posto n = 1 e Z = 2
EHe+ = – 4 K
L’energia dell’elettrone ionizzato si pone pari a zero in quanto tale elettrone si trova a distanza infinita dallo ione e EHe = – 11K/2. Pertanto I, il potenziale di prima ionizzazione dell’elio è pari a:
I = 11 K/2 – 4 K = 3 K /2
che è quindi 1.5 volte maggiore rispetto a quello dell’atomo di idrogeno.
Il valore sperimentale relativo all’allontanamento di entrambi gli elettroni dell’elio si discosta del 5% da quello teorico, tuttavia la percentuale di errore aumenta se si paragona il valore sperimentale rispetto a quello teorico per il potenziale di prima ionizzazione dell’elio. Per comprendere la motivazione di tale discrepanza si deve introdurre il concetto di carica nucleare effettiva che è la carica di cui realmente risente un elettrone in un atomo polielettronico.