Spettri atomici
Gli spettri atomici sono definiti come lo spettro della radiazione elettromagnetica emessa o assorbita da un elettrone durante le transizioni tra diversi livelli energetici all’interno di un atomo. Quando un elettrone viene eccitato da un livello energetico a un altro, emette o assorbe luce di una lunghezza d’onda specifica.
Vi sono tre tipi di spettri atomici ovvero gli spettri di emissione, di assorbimento e continui. Gli spettri atomici di emissione si verificano quando un elettrone da stato eccitato ritorna ad un livello energetico inferiore perdendo energia.
Gli spettri atomici di assorbimento sono costituiti dalle frequenze della luce trasmessa con bande scure quando l’energia viene assorbita dagli elettroni nello stato fondamentale per raggiungere stati energetici più elevati. Gli spettri atomici continui derivano da gas densi o oggetti solidi che irradiano calore.
Spettri atomici di emissione
Gli spettri atomici discreti e non continui sono un risultato osservabile della fisica degli atomi. A differenza di una sorgente a spettro continuo, che può irradiarsi con tutte le lunghezze d’onda, le nubi di elettroni che circondano i nuclei degli atomi hanno energie molto specifiche dettate dalla meccanica quantistica.
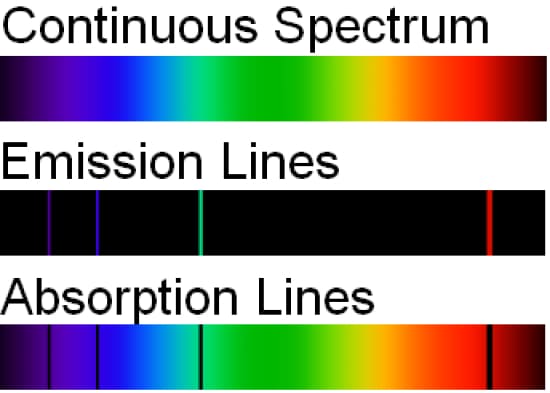
Ogni elemento della tavola periodica ha il proprio insieme di possibili livelli energetici. Gli elettroni tendono a stabilizzarsi nello stato fondamentale, quindi un atomo eccitato con un elettrone in un livello energetico più elevato emetterà un’onda di luce con quell’esatta energia per consentire all’elettrone di cadere nello stato fondamentale.
Questa energia corrisponde a un colore specifico, o lunghezza d’onda, della luce, quindi vediamo una linea luminosa a quella esatta lunghezza d’onda. Possiamo osservare righe di emissione negli spettri di comete, nebulose e alcuni tipi di stelle.

La quantità di energia che un elettrone perde passando dallo stato eccitato allo stato fondamentale è pari alla differenza tra i livelli di energia tra cui si muove. Questa energia viene rilasciata come un fotone che può essere calcolata utilizzando l’equazione:
ΔE = hν
essendo ΔE = E2 – E1 ovvero data dalla differenza tra il livello 2 (stato eccitato) e il livello 1 (stato fondamentale); h è la costante di Planck e ν è la frequenza della radiazione.
Poiché i livelli di energia hanno valori diversi, ciascuna delle possibili transizioni elettroniche all’interno di un atomo produrrà un fotone con un’energia diversa. Ciò significa che ciascuna transizione elettronica produrrà un fotone di frequenza diversa e quindi di colore diverso con formazione di spettri atomici di emissione rappresentati da linee.
Linee spettrali dell’idrogeno
Lo spettro dell’idrogeno è il più semplice degli spettri a righe poiché l’idrogeno è costituito solo dal nucleo contenente un protone intorno al quale si muove un elettrone. Dopo che un elettrone passa dallo stato fondamentale allo stato eccitato passa ad un orbitale ad energia minore rilascia una certa quantità di energia sotto forma di radiazione avente una determinata lunghezza d’onda e dando origine ad una riga di emissione.
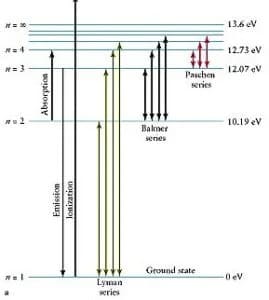
Le transizioni che gli elettroni compiono dagli orbitali periferici a quelli più interni si possono ordinare secondo valori decrescenti di energia: le variazioni di energia più elevate si registrano quando un elettrone passa da un’orbitale periferico a quello corrispondente allo stato fondamentale.
L’insieme di tutti i salti che terminano nell’orbitale 1s dà luogo a una serie di linee spettrali che prendono il nome di serie di Lyman, scoperta dal fisico americano Theodore Lyman e così denominata in suo onore, le prime righe della quale vengono indicate con Lα, Lβ, Lγe corrispondono alle energie delle righe dell’ultravioletto.
A valori di energia immediatamente più bassa si trovano i salti dell’elettrone dalle orbite periferiche alla seconda orbita stazionaria: si hanno energie proprie dello spettro del visibile e si ottengono righe della serie di Balmer che prendono il nome dal matematico svizzero Johann Jakob Balmer
La prima riga è originata da un salto dall’orbita 3 all’orbita 2 e viene indicata con Hα, la seconda dalla 4 alla 2 e viene indicata con Hβ mentre la terza indicata con Hγ corrisponde al salto dall’orbita 5 alla 2. Lo stesso discorso si ripete per la serie di Paschen scoperta dal fisico tedesco Friedrich Paschen nel 1908 le cui righe corrispondono all’energia delle righe dell’I.R.



