Tricloroetano
L’1,1,1-tricloroetano detto anche metil cloroformio è un alogenuro alchilico con formula CH3CCl3 identificato per la prima volta nel 1840 dal chimico e fisico francese Henri Victor Regnault. Ha trovato utilizzo come solvente nella seconda metà del XX secolo in sostituzione di altri solventi clorurati e infiammabili come il tetracloruro di carbonio.
Sebbene l’1,1,1- tricloroetano sia stato utilizzato in una gamma di applicazioni industriali e prodotti di consumo, compresi prodotti come adesivi e detergenti adesivi, lubrificanti, detergenti liquidi per uso generale, sgrassanti spray, detergenti per forno, smacchiatori, lucidi per scarpe, finiture per tessuti e come precursore degli idrofluorocarburi, non è più utilizzato nei comuni prodotti domestici.
Infatti, dopo la stipula del protocollo di Montreal del 1987 “a favore della protezione dell’ozono stratosferico”, i livelli di produzione e di consumo dell’1,1,1- tricloroetano unitamente a bromoclorodifluorometano, tetracloruro di carbonio, clorofluorocarburi, idroclofluorocarburi, bromuro di metile e bromoclorometano hanno subito una limitazione e una graduale eliminazione.
Proprietà dell’1,1,1-tricloroetano
L’1,1,1-tricloroetano si presenta come un liquido incolore a temperatura ambiente avendo una temperatura di fusione di – 30°C e una temperatura di ebollizione di 74°C. Ha una scarsa solubilità in acqua che, alla temperatura 25°C è di 1.29 g/L.

È solubile in etanolo, cloroformio, acetone, benzene, metanolo, tetracloruro di carbonio, etere etilico e nella maggior parte dei solventi organici. Ha un odore dolce e gradevole simile a quello del cloroformio. Può irritare la pelle, gli occhi e le mucose. In alte concentrazioni i vapori possono avere un effetto narcotico. Non è infiammabile, ma può decomporsi ed emettere fumi tossici di cloro se è esposto a temperature elevate.
L ‘1,1,1-tricloroetano, a temperature superiori a 260°C si decompone per formare cloruro di idrogeno, dicloroetene e tracce di fosgene, che sono gravi irritanti polmonari. A causa del suo elevato coefficiente di partizione ha una notevole mobilità nel suolo e può facilmente raggiungere le falde acquifere.
Sintesi
Tutto l’1,1,1-tricloroetano presente nell’ambiente è di origine sintetica poiché non è presente in natura. È prodotto, a livello industriale a partire dal cloroetene noto come cloruro di vinile in un processo che avviene in due stadi.
Nel primo stadio il cloruro di vinile viene fatto reagire a 20-50°C con il cloruro di idrogeno in presenza di acidi di Lewis quali catalizzatori e, in particolare del cloruro di alluminio, cloruro di ferro (III) o cloruro di zinco con formazione di 1,1-dicloroetano:
CH2=CHCl + HCl → CH3CHCl2

L’1,1-dicloroetano viene successivamente fatto reagire con il cloro in presenza di luce U.V. che catalizza la reazione:
CH3CHCl2 + Cl2 → CH3CCl3 + HCl
da cui si ottiene, oltre all’1,1,1-tricloroetano anche cloruro di idrogeno che può essere riutilizzato nel processo per il primo stadio.
Dalla reazione che ha una resa dell’80-90% si ottengono sottoprodotti quali l’isomero 1,1,2-tricloroetano che può essere separato dall’ l’1,1,1-tricloroetano tramite distillazione.
Un’altra via sintetica prevede la reazione dell’1,1-dicloroetene con cloruro di idrogeno in presenza di acidi di Lewis quali catalizzatori secondo la reazione:
CH2=CCl2 + HCl → CH3CCl3
L’1,1,1-tricloroetano può anche essere ottenuto dall’alogenazione dell’etano sebbene dalla reazione, che avviene per via radicalica, si ottengano numerosi sottoprodotti
1,1,1-tricloroetano e ambiente
L’1,1,1-tricloroetano entra nell’ambiente principalmente attraverso la sua evaporazione nell’atmosfera, anche se una parte viene scaricata da effluenti industriali. Si è stimato che nell’aria abbia un tempo di dimezzamento di 26 settimane analogamente a diclorometano e cloroformio ma molto maggiore rispetto alla maggior parte degli altri cloroidrocarburi.
Quando l’1,1,1-tricloroetano entra nella troposfera, viene ossidato per reazione con i radicali ossidrili liberi prodotti dall’azione delle radiazioni U.V. per formare tricloroacetaldeide Cl3CCHO che viene ulteriormente ossidata ad acido tricloroacetico Cl3CCOOH.
Il 15% dell’1,1,1-tricloroetano viene trasportato nella stratosfera dove viene degradato da processi fotochimici indotti dalla radiazione solare con maggiore energia e una lunghezza d’onda compresa tra 170 e 240 nm. Si verificano quindi processi che non avvengono nella troposfera e portano alla formazione tramite scissione omolitica di un atomo di cloro radicale:
CH3CCl3 → CH3CCl2· + Cl·
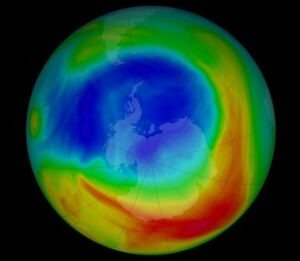
Il cloro radicale reagisce con l’ozono secondo la reazione Cl· + O3 → ClO· + O2 e pertanto è una delle specie che provoca la formazione del buco dell’ozono.
Usi
L’1,1,1-tricloroetano era ampiamente utilizzato nella produzione di idroclorofluorocarburi (HCFC), come solvente per rimuovere olio o grasso dai materiali come apparecchiature elettriche, motori, componenti elettronici, pellicole fotografiche, circuiti stampati, tessuti, o per solubilizzare altre sostanze come colle, inchiostri da stampa e vernici.
L’1,1,1-tricloroetano veniva usato anche come fumigante per alimenti e cereali ed era presente in prodotti come smacchiatori, colle e quale propellente negli spray. Oggi l’unico utilizzo significativo dell’1,1,1-tricloroetano è nella produzione di idrofluorocarburi e quale intermedio nella produzione di altri prodotti chimici.
Tuttavia, poiché il Protocollo di Montreal non è stato ratificato da alcuni paesi questo alogenuro alchilico viene ancora utilizzato, oltre che come solvente, anche nell’industria elettronica nella fabbricazione di circuiti stampati e nell’industria dei semiconduttori dove viene utilizzato per la pulizia secondaria.



