Formammide: sintesi, reazioni, usi
La formammide il cui nome I.U.P.A.C. è metanammide è la più semplice delle ammidi. Si presenta sotto forma di liquido viscoso, incolore, dall’odore di ammoniaca con un punto di fusione di 2°C e un punto di ebollizione di 210°C.
È insolubile in etere e solventi clorurati, poco solubile in benzene e solubile in acqua, metanolo, etanolo, acido acetico, acetone, 1,4-diossano, glicole etilenico e fenolo.
La sua formula è HCONH2 e la sua struttura è quella rappresentata in figura:
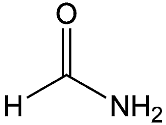
e pertanto contiene due gruppi funzionali ovvero il gruppo carbonilico e quello amminico.
Nel 1920 i chimici tedeschi Meyer e Othmer scoprirono che la formammide poteva essere ottenuta per reazione a caldo tra ammoniaca e biossido di carbonio.
Sintesi
La formammide può essere ottenuta per reazione tra:
- acido formico e ammoniaca con formazione del formiato di ammonio. A seguito di riscaldamento si ottiene formammide e acqua
HCOOH + NH3 → HCOONH4+ → HCONH2 + H2O
- formiato di etile e ammoniaca
HCOOCH2CH3 + NH3 → HCONH2 + CH3CH2OH
- monossido di carbonio e ammoniaca
CO + NH3 → HCONH2
Reazioni
La formammide reagisce con:
- idrossido di sodio per dare formiato di sodio e ammoniaca:
HCONH2 + NaOH → HCOONa + NH3
- acqua in ambiente acido per dare acido formico e cloruro di ammonio:
HCONH2 + HCl + H2O → HCOOH + NH4Cl
- gli acidi che hanno azione catalitica per dare una reazione di disidratazione con formazione di acido cianidrico e acqua:
HCONH2 → HCN + H2O
Usi
La formammide è utilizzata per la produzione di coloranti, vernici, adesivi, come solvente nella fabbricazione e nella lavorazione di materie plastiche.
È inoltre usata per ottenere prodotti farmaceutici, agenti per la protezione delle colture, fungicidi e pesticidi.
Nell’ambito delle sintesi organiche è usata per l’ottenimento di composti eterociclici come imidazolo, 1,3,5-triazina, caffeina e teobromina



