Produzione elettrolitica della soda caustica
La produzione elettrolitica della soda caustica può essere attuata con la tecnica a diaframma o con la tecnica a catodo mobile di mercurio.
La tecnica a diaframma
Una soluzione (salamoia) di NaCl viene elettrolizzata e si ottengono i prodotti gassosi Cl2 e H2 e una soluzione di NaOH come residuo liquido. La tecnica a diaframma utilizza un setto poroso per separare i compartimenti anodico e catodico.
L’elettrolisi della salamoia viene continuata fino a consumare circa il 50% del cloruro di sodio introdotto nella cella detta Hooker cell. La reazione complessiva è:
2 Na+ + 2 Cl– + 2 H2O → 2 Na+ + 2 OH– + H2 + Cl2
ovvero all’anodo si scarica Cl– (E° = 1.395 V) e H2O all’anodo (E° = – 0.828 V) mentre rimangono in soluzione Na+ e OH–.
Semireazione catodica: 2 H2O + 2 e– → H2 + OH–
Semireazione anodica : 2 Cl– → Cl2 + 2 e–
Il diaframma interposto tra anodo e catodo non serve solo a separare i due gas prodotti, ma ad evitare il più possibile la diffusione di OH– nella salamoia. Questa è introdotta nel compartimento anodico e mantenuta costantemente a livello più elevato che nell’altro compartimento al fine di limitare la diffusione. Se tale accorgimento non fosse adottato si potrebbero verificare le seguenti reazioni:
a) Cl2 + OH– → Cl– + HClO
b) HClO → H+ + OCl–
c) 2 HClO + OCl– → 2 Cl– + ClO3– + 2 H+
d) 4 OH– → O2 + 2 H2O + 4 e–
Tali reazioni diventerebbero prioritarie se si protraesse l’elettrolisi fino a consumare il 60-65% della salamoia introdotta. La salamoia residua si centrifuga per separare NaCl che a tale concentrazione è praticamente insolubile in modo da essere riciclato. La soluzione contenente NaOH si concentra o si cristallizza. L’idrogeno prodotto è utilizzato quale combustibile e il cloro lo si conserva refrigerato in appositi serbatoi.
Un tempo si adoperavano anodi di grafite compatta, ma a causa della temperatura di esercizio ( 65/75 °C) si verificava la corrosione degli anodi secondo la reazione:
4 OH– + C → CO2 + 2 H2O + 4 e–
Attualmente si usano anodi di titanio ricoperti di ossido di rutenio o di palladio detti anodi DSA ( dimensionally stable anodes) che non sono attaccati dal cloro. I catodi erano costituiti da una maglia di ferro rivestita di amianto che fungeva da diaframma. Attualmente, essendo stato bandito l’uso dell’amianto per il suo potere cancerogeno, viene utilizzato un materiale membranoso il nafion ,solfonato tetrafluoroetilene, permeabile a Na+ e ad OH– ma non a Cl–.
[irp posts=”6465″ ]
Tecnica a catodo mobile di mercurio ( cella Castner-Kellner)
Tramite tale tecnica si fa avvenire l’elettrolisi della salamoia su catodo di mercurio generando un amalgama a potenziale di riduzione più basso rispetto a quello del sodio.
L‘ossidazione è identica a quella che avviene nella cella a diaframma con relativo sviluppo di Cl2. Il catodo è costituito di un letto di mercurio che scorre controcorrente rispetto alla salamoia.
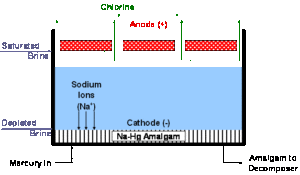 La riduzione fornisce l’amalgama:
La riduzione fornisce l’amalgama:
semireazione catodica: 2 Na+ + 2 e– + Hg → Na2Hg
l’amalgama è fatto fluire entro una cella elettrolitica secondaria detta cella di denudamento dove esso funge da anodo. Il catodo è ferro o grafite e la soluzione è NaOH diluita.
Introducendo H2O, il sodio amalgamato si ossida, con produzione di H2:
Semireazione anodica : Na2Hg → 2 Na+ + 2 e– + Hg
Semireazione catodica: 2 H2O + 2 e– → 2 OH– + H2
Anche nella cella a mercurio gli anodi sono di DSA e il rendimento è del 50%.
Inutile sottolineare che i residui del processo a causa della presenza di mercurio sono tossici oltre che cancerogeni e pertanto sono trattati in modo adeguato.




