Minerali metalliferi: riduzione dei metalli
I minerali metalliferi possono contenere uno o più metalli e sono definiti tali se è conveniente da un punto di vista economico estrarre da essi un metallo.
Le materie prime che sono utilizzate per l’ottenimento dei metalli sono i minerali metalliferi. Alcuni metalli quali platino, oro, argento hanno scarsa tendenza a ossidarsi e si trovano più facilmente allo stato ridotto ovvero metalli allo stato natio.
La maggior parte dei metalli si trovano nello stato ossidato cioè come composti principalmente sotto forma di ossidi (ematite Fe2O3, magnetite Fe3O4, cassiterite SnO2), ossidi idrati ( bauxite Al2O3· H2O), solfuri (galena PbS, pirite FeS2, calcopirite CuFeS2, blenda ZnS) , carbonati (calcare CaCO3, dolomite CaMg(CO3)2, cloruri (carnallite KCl·MgCl2·6 H2O). Salvo poche eccezioni quindi la preparazione dei metalli è fondamentalmente un problema di riduzione.
I minerali metalliferi contengono impurezze (ganga) a volte in grande quantità; sono cioè minerali grezzi e devono essere sottoposti a trattamenti il cui scopo è quello di allontanare il più possibile le impurezze e aumentare la concentrazione della sostanza utile. I vari trattamenti di concentrazione vengono adottati in base alle caratteristiche del materiale.
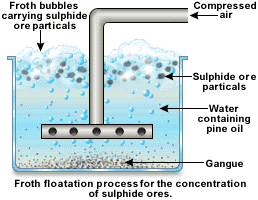
Flottazione
Il primo dei trattamenti che è effettuato consiste nella flottazione in cui è sfruttata la differenza di polarità e quindi di affinità con l’acqua fra la ganga e il minerale. Trovano utilizzo per i solfuri in cui la ganga, essendo calcarea, è assai più polare e idrofila del minerale. La flottazione si realizza polverizzando i minerali metalliferi, sospendendolo in acqua contenente oli ed agitando in presenza di tensioattivi; si forma una schiuma che, salendo in alto, trascina con sé le particelle di solfuro poco solubili in acqua e rivestite di una pellicola oleosa che ne diminuisce la bagnabilità favorendone il galleggiamento mentre la ganga idrofila resta sul fondo del bacino di flottazione.
Levigazione
La levigazione è effettuata quando tra il minerale e la ganga che lo accompagna esiste una notevole differenza di peso specifico; il materiale, previamente macinato, viene sottoposto all’azione di una corrente d’acqua che trascina più lontano le particelle meno pesanti. La levigazione si pratica, ad esempio, nelle sabbie aurifere sfruttando la notevole differenza tra il peso specifico dell’oro e quello della sabbia.
Concentrazione elettromagnetica
La concentrazione elettromagnetica è applicabile ai minerali metalliferi in cui un componente è in possesso di proprietà magnetiche; la separazione si realizza sottoponendo il materiale polverizzato all’azione di un’elettrocalamita.
Una volta che si è ottenuto il minerale arricchito si effettua la riduzione
Riduzione
Sugli ossidi si esegue la riduzione con carbone o con un ossido di carbonio; ad esempio:
SnO2 + 2 C → Sn + 2 CO ↑
Fe2O3 + 3 CO → 2 Fe + 3 CO2 ↑
Se gli ossidi dei metalli hanno potenziali redox molto bassi i metalli tendono a mostrare poca tendenza ad accettare elettroni ed è necessario un processo di riduzione più energico:
- Mediante elettrolisi dell’ossido fuso che si pratica, ad esempio, per l’alluminio:
Al2O3 → 2 Al3+ + 3 O2- (Fusione)
Al3+ + 3 e– → Al (Reazione catodica di elettrolisi)
- Con alluminio: metodologia applicata, ad esempio, per gli ossidi di cromo:
Cr2O3 + 2 Al → 2 Cr + Al2O3
I solfuri devono essere trasformati in ossidi per riscaldamento all’aria. Il processo è detto arrostimento e nel corso di esso la zolfo si ossida ad anidride solforosa; l’ossido viene sottoposto a riduzione con carbone:
2 ZnS + 3 O2 → 2 ZnO + 2 SO2 ↑
ZnO + C → Zn + CO ↑
I carbonati vengono anch’essi trasformati in ossidi per riscaldamento e il processo, nel corso del quale si libera anidride carbonica, è detto calcinazione e può comportare anche ossidazione del metallo ad opera dell’ossigeno atmosferico con successiva riduzione degli ossidi:
4 FeCO3 + O2 → 2 Fe2O3 + 4 CO2 ↑ ( Calcinazione)
Fe2O3 + 3 CO → 2 Fe+ 3 CO2 ( Riduzione)