Grafici delle leggi cinetiche: ordine di reazione
I grafici delle leggi cinetiche per reazioni di diverso ordine consentono di sapere la dipendenza del tempo in funzione della concentrazione o del logaritmo della concentrazione
Data la reazione:
a A + b B → c C + d D
l’espressione della legge della velocità è la seguente:
velocità della reazione = k [A]x[B]y
dove [A] e [B] rappresentano le concentrazioni delle specie A e B rispettivamente;
k è il coefficiente di velocità della reazione, x e y devono essere determinati sperimentalmente e sono gli ordini rispetto ad A e B.
La somma delle potenze è detto ordine di reazione, pertanto l’ordine delle reazione è dato dalla somma x + y.
Ordine di reazione
L’ordine della reazione da cui si ottiene le legge della velocità non può essere previsto dalla stechiometria della reazione.
Si possono verificare i seguenti casi:
1) Se la velocità della reazione è indipendente dalla concentrazione dei reagenti essa è di ordine zero e si ha: velocità = k.
L’unità di misura di k è M/s
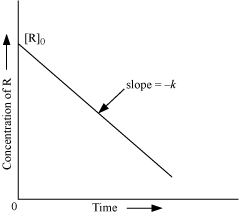
La legge integrata della velocità per una reazione di ordine zero è:
[A] = [A]o – kt
Dove [A]o è la concentrazione iniziale di A. Tale equazione è del tipo y = mx + n in cui mx = -kt e n = [A]o
Pertanto riportando in grafico la concentrazione in funzione del tempo si ottiene una retta la cui pendenza è –k.
2) Se la velocità della reazione è proporzionale solo alla concentrazione di A essa è del primo ordine: velocità = k [A]
L’unità di misura di k è s-1.
La legge integrata della velocità per le reazioni del primo ordine, ovvero la legge che correla la concentrazione di un reagente al tempo può essere scritta in due modi diversi ovvero
- in forma esponenziale: [A] = [A]oe-kt
dove [A]o è la concentrazione iniziale, [A] è la concentrazione dopo un certo tempo t e k è la costante di velocità. Riportando in grafico la concentrazione in funzione del tempo si ottiene una curva.
- in forma logaritmica: ln [A] = – kt + ln [A]o
che corrisponde all’equazione di una retta essendo del tipo y = mx+n dove m è la pendenza della retta e n è l’intercetta sull’asse y. Quindi la pendenza della retta è –k mentre l’intercetta sull’asse delle y è ln [A]o.
Grafici
I grafici relativi alle due espressioni sono rappresentati in figura:
Si noti che, riportando ln [A] in funzione del tempo, se i dati sperimentali non si allineano secondo una retta la reazione non è del primo ordine.
3) Se la velocità della reazione è proporzionale alla concentrazione di A e di B essa è del secondo ordine: velocità = k [A][B]
Il tipo più semplice di reazione del secondo ordine si ha per una reazione come:
2 A → prodotti
Per la quale si ha: velocità = k[A]2 il che implica che raddoppiando la concentrazione di A la velocità quadruplica. L’unità di misura di k per una reazione del secondo ordine è M-1 s-1 ovvero l/mol·s
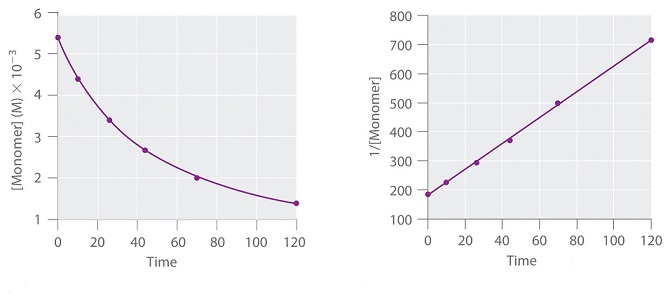
La legge integrata per una reazione del secondo ordine è:
1/[A] = 1/[A]o + kt
che corrisponde all’equazione di una retta essendo del tipo y = mx+n in cui n = 1/[A]o .
Riportando in grafico [A]o in funzione del tempo si ottiene una curva mentre riportando 1/[A]o in funzione del tempo si ottiene una retta
La conoscenza della legge di velocità consente, tra l’altro di avere informazioni relative al meccanismo della reazione stessa.